- 50 毫升的法尔肯管袋
- 纯乙醇(EtOH),分子生物学级
- 分子生物学级水
- 克雷斯紫
- 铝箔
- 适用于LMD阶段收集器的 0.5 或 0.2 毫升薄壁 PCR 管,带平盖
- 移液管尖(适用于 1 毫升移液管和 20 微升移液管)
- 带无菌过滤嘴的注射器
- 冰
- 冷冻切片机刀片
- 聚乙烯薄膜
- 徕卡 LMD 切片(例如 4 µm PEN 框架)
- 硅胶袋
- Kimwipes
上游准备
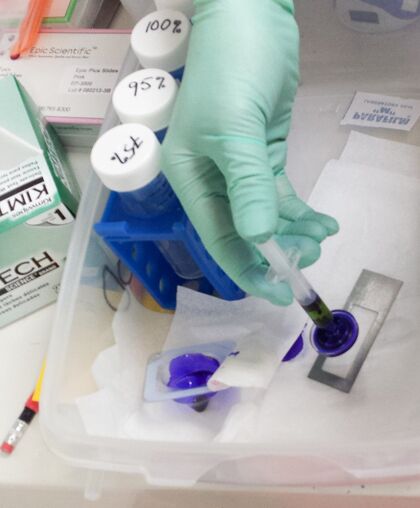
1% 磷酸紫(CV)溶液在 100% 乙醇(EtOH)中:将 500 毫克磷酸紫粉末加入 50 毫升法尔肯管中,然后加入 100% 乙醇填满 50 毫升。应在使用前 1 周准备。将法尔肯管放入冰箱,覆盖铝箔(磷酸紫对光敏感),并每天轻轻摇晃。
用于固定和洗涤步骤的乙醇行:
- 2 次 75% 乙醇:将 37.5 毫升乙醇倒入 50 毫升法尔肯管中,然后加入分子生物学级水至 50 毫升
- 将一个 75% 乙醇的法尔肯管放入-20°C 冰箱
- 95% 乙醇:将 47.5 毫升乙醇倒入 50 毫升法尔肯管中,然后加入分子生物学级水至 50 毫升
- 100 % 乙醇 50 毫升乙醇倒入 50 毫升法尔肯管
- 法尔肯管中的乙醇可以重复使用最多 3 天。
重要提示:
- 用 Parafilm 密封法尔肯管以便存储 → 这将防止乙醇蒸发!
- 将 LMD 切片放在 UV-C 光下 10 分钟 → 激活膜以提高切片粘附性并消毒表面!
- 将 0.2 或 0.5 毫升的试管盖子打开,放在UV-C 光下至少 30 分钟 → 消毒并消除任何 RNA 和 RNase!
- 准备三个 50 毫升的 Falcon 管,里面放一些硅胶袋 → 硅胶将保持载玻片和切片干燥,处理 RNA 时,湿度和水分是你的敌人,因为它们可能激活 RNase!
在平衡后,准备适当厚度的切片(厚度应根据感兴趣细胞的直径选择,本测试准备了 10 微米的切片)。
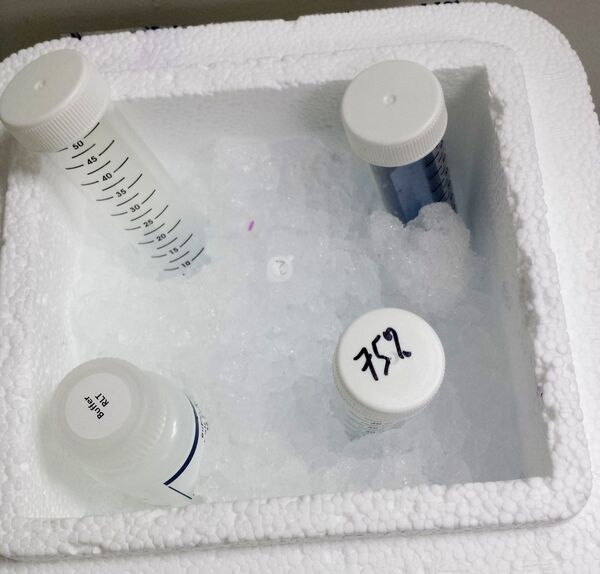
将一片(卷曲的)切片直接从冷冻状态放入 0.5 毫升的管中,并立即加入 350 微升 RLT 缓冲液(Qiagen Micro RNeasy 试剂盒的内容)。这将作为质量和数量的阳性对照。
将载玻片与切片放入含 75%乙醇溶液的法尔康管中,温度为-20°C,浸泡 2 分钟(短暂固定)。2 分钟后,简要空气干燥载玻片,并将其存放在一个 50 毫升的法尔康管中,里面放一些硅胶袋(以保持干燥)。
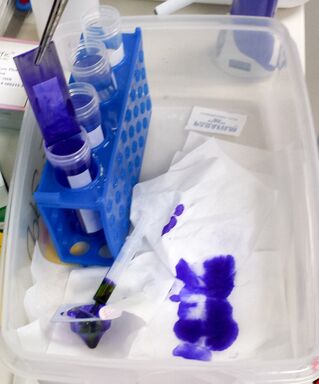
用注射器通过无菌过滤嘴在另一部分和载玻片上重复此染色,但要添加一些 1%的 cresyl violet 溶液。将染色溶液在切片上放置 1 分钟。之后,将载玻片短暂浸入 75%乙醇、95%乙醇和最后的 100%乙醇中以洗去 cresyl violet。短暂空气干燥载玻片,并将其存放在一个 50 毫升的 Falcon 管中,里面放一些硅胶袋以保持干燥。
用另一部分和载玻片重复整个过程。
LMD 测试幻灯片
你现在应该有:
- 1 个装有 350 µl RLT 缓冲液的管子(阳性对照)
- 一段固定在载玻片上的切片,使用乙醇固定,存放在一个 50 毫升的法尔肯管中,里面有硅胶袋
- 两个载玻片上固定的切片,使用乙醇固定并用 CV 染色,存放在一个 50 毫升的法尔肯管中,里面有硅胶袋
未染色切片的载玻片用作另一个对照。因此,直接用 RLT 缓冲液从膜上消化,并转移到 0.5 毫升的管中(RLT 缓冲液的总量必须为 350 微升,不要将其全部用于从载玻片上消化,因为这会冲洗掉载玻片!)。
固定并染色的切片之一用作另一个对照。因此,直接用 RLT 缓冲液从膜上消化,并转移到 0.5 毫升的管中(RLT 缓冲液的总量必须为 350 微升,不要将其全部用于从载玻片上消化,因为这会冲洗掉载玻片!)。
徕卡LMD激光显微切割 系统用于 RNA 分析
剩余的固定和染色切片用于LMD。因此,将切片放入样本架中,并在收集架中放入一个 0.5 毫升的管子。选择已加载收集器的位置,并使用 LMD 软件 标记整个切片进行解剖,使用所需的放大倍数。启动激光,并在解剖后检查所有切片是否已收集在收集管中。如有必要,使用 Move+Cut 重新切割切片,以确保所有切片都被收集。
卸下收集管,小心地关闭盖子并简要离心解剖物。打开盖子,加入 350 µl RLT 缓冲液(在切割之前可以向收集盖中添加最多 65 µl RLT 缓冲液)。
加载另一个收集帽,并在收集区域附近解剖空膜(大约相同的面积大小,以µm²为单位)。卸下收集管,小心关闭盖子并简要离心解剖物。打开盖子,加入 350 µl RLT 缓冲液(在切割之前可以向收集帽中添加最多 65 µl RLT 缓冲液)。该管将作为后续的LMD阴性对照。
激光微切割后的准备和处理
- 向含有 RPE 的瓶子中添加 44 毫升,并勾选复选框以确保添加了 EtOH。
- 准备 70% EtOH 溶液:向 50 毫升的 Falcon 管中添加 35 毫升 100% EtOH,并添加 15 毫升分子生物学级水。
- 准备 80% EtOH 溶液:向 50 毫升的 Falcon 管中添加 40 毫升 100% EtOH,并添加 10 毫升分子生物学级水。
6.丢弃流出液,将柱子放入新的 2 毫升管中,并添加 500 微升 RPE(之前添加了乙醇)以清洗柱子。
7.以 10,000 转/分钟旋转 15 秒。
8.丢弃流出液并添加 500 微升 80%乙醇以清洗柱子。
9.以 13,000 转/分钟旋转 2 分钟
10.丢弃流出液,将柱子放入一个新的 2 毫升试管中
11.以最大速度旋转 5 分钟,盖子打开,以干燥柱子的硅胶膜
12.在 14 微升水中洗脱:小心地将 14 微升无 RNA 酶水移液到柱膜的中间,并将柱子放入一个新的标记好的 1.5 毫升试管中
13.以 13,000 转/分钟旋转 1 分钟
14.小心地将流出液重新移液到柱膜的中间
15.以 13,000 转/分钟旋转 2 分钟
洗脱液应储存于–80 °C,或如果可能,立即用于质量和数量的评估。
简要协议摘要
样本:
A – 直接从冷冻样本中提取的样本(整体阳性对照)
B – 固定样本,通过移液管提取(阳性对照,乙醇固定的影响)
C – 固定并染色的样本,通过移液管提取(阳性对照,乙醇固定和染色的影响)
D – 固定并染色的样本,通过LMD收集(LMD的影响)
E – 收集在样本旁边的空膜(LMD 过程/污染的阴性对照)
F – RLT 缓冲液下游纯化的阴性对照
使用 Qiagen Micro 试剂盒提取的 RNA:
- 添加 350 µl RLT 缓冲液
- 添加 350 µl 70%乙醇,用移液器混合并直接转移到柱中
- 旋转 15 秒,10,000 转/分钟
- 丢弃流出液并用 350 µl RW1 洗涤
- 旋转 15 秒,10,000 转/分钟
- 丢弃流出液并用 500 µl RPE(添加了乙醇)
- 旋转 15 秒,10,000 转/分钟
- 丢弃流出液并用 500 µl 80%乙醇洗涤
- 离心 2 分钟,10,000 转/分钟
- 丢弃流出液
- 离心 2 分钟,最大速度,盖子打开以干燥膜
- 用 14 µl 水洗脱*
- 旋转 1 分钟,满速
- 使用洗脱液并将其放回柱中
- 旋转 1 分钟,满速
| 好 | RIN® | 28S/18S (高度) | 28S/18S (区域) | 浓度 (ng/µl) | 样本描述 | 警报 | 观察 | 总 RNA 区域 | rRNA 区域 |
|---|---|---|---|---|---|---|---|---|---|
| A0 | – | – | – | 137 | 梯子 | – | – | ||
| A1 | 7.4 | 1.4 | 1.9 | 69.1 | A | 2.79 | 0.61 | ||
| B1 | 7.1 | 1.3 | 1.9 | 84.5 | B | 3.41 | 0.76 | ||
| C1 | 7.3 | 1.4 | 2.0 | 127 | C | 5.13 | 1.26 | ||
| D1 | 7.2 | 1.0 | 2.0 | 83.6 | D | 3.38 | 0.78 | ||
| E1 | 6.5 | 0.4 | 0.4 | 110 | E | 4.44 | 0.98 | ||
| D9 | 6.9 | 0.7 | 0.9 | 67.3 | D | 2.68 | 0.59 | ||
| C2 | – | – | – | 7.36 | K | ! | RNA 浓度超出 RINe 推荐范围 | 0.30 | – |
| D2 | – | – | – | 6.57 | L | ! | RNA 浓度超出 RINe 推荐范围 | 0.27 | – |
| 样本名称 | 材料 | 日期 | 时间 | A260 浓度 (ng/ul) | A260 (10 mm) | A280 (10 mm) | A260/A280 | A260/A230 |
|---|---|---|---|---|---|---|---|---|
| blank_6 | RNA | 11.12.2014 | ###### | 0 | 0 | 0 | – | – |
| A | RNA | 11.12.2014 | ###### | 32.42 | 0.81 | 0.41 | 1.98 | 0.13 |
| B | RNA | 11.12.2014 | ###### | 48.18 | 1.2 | 0.58 | 2.07 | 0.1 |
| C | RNA | 11.12.2014 | ###### | 71.01 | 1.78 | 0.89 | 2 | 1.51 |
| D | RNA | 11.12.2014 | ###### | 48.32 | 1.21 | 0.54 | 2.24 | 0.03 |
| E | RNA | 11.12.2014 | ###### | 64.65 | 1.62 | 0.73 | 2.2 | 0.06 |
| D | RNA | 10.12.2014 | ###### | 41.79 | 1.04 | 0.47 | 2.23 | 0.03 |
| K | RNA | 11.12.2014 | ###### | 1.72 | 0.04 | 0.02 | 1.97 | 0.02 |
| L | RNA | 11.12.2014 | ###### | 0.74 | 0.02 | 0.01 | 2.91 | 0.02 |
质量
所有样本(A–D)在不同处理下的质量几乎相同(RIN 7.1–7.4)。没有发现对 EtOH 固定、染色和 Leica LMD 解剖的影响。
将切片在 Parafilm 密封的 50 毫升 Falcon 管中冷冻储存于–80 °C 过夜,逐步在–20 °C 冰箱中解冻 20 分钟,在 4 °C 冰箱中解冻 20 分钟,然后在室温下解冻 15 分钟,重新打开 Falcon 管后,Leica LMD 解剖的结果也相当可比(样本 E1&D9,RIN 6.9 和 6.5)。
所有阴性对照均为空。
数量
所有样本(A–D)在不同处理下几乎具有相同的数量,只有样本 C(固定、染色并直接从载玻片上挑选)显示出比阳性对照(样本 A)更高的数量。未检测到乙醇固定、染色或 Leica LMD 解剖的影响。
将载玻片在密封的 50 毫升 Falcon 管中冷冻储存于–80 °C 过夜,随后在–20 °C 冰箱中逐步解冻 20 分钟,在 4 °C 冰箱中 20 分钟,以及在室温下 15 分钟后重新打开 Falcon 管,导致在 Leica LMD 解剖后结果相当(样本 E1 和 D9,储存后数量略高)。
所有阴性对照均为空。
不同的测量方法导致不同的结果 → 测量的共同不准确性。
总结来说,这些数据清楚地表明工作流程不会影响 RNA 的质量或数量。