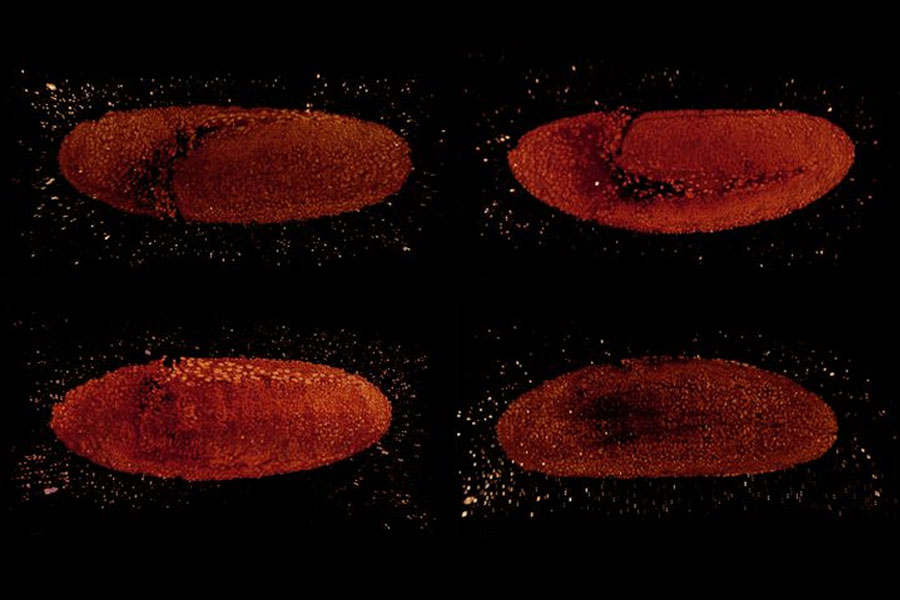
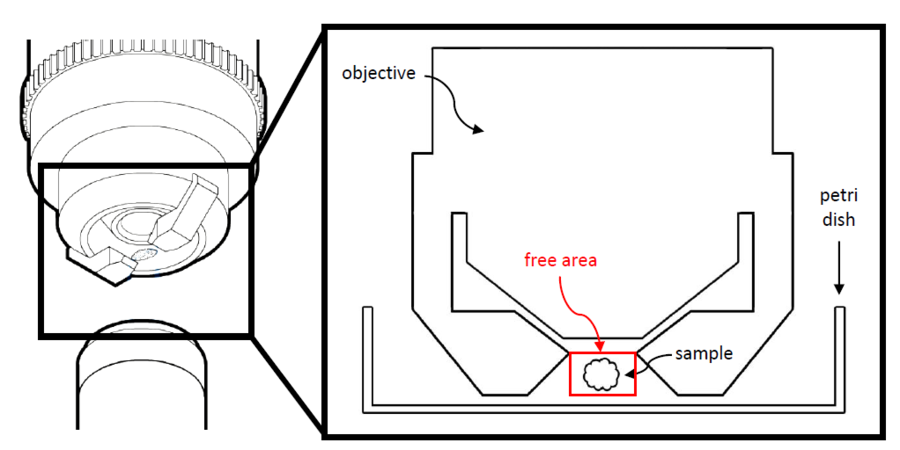
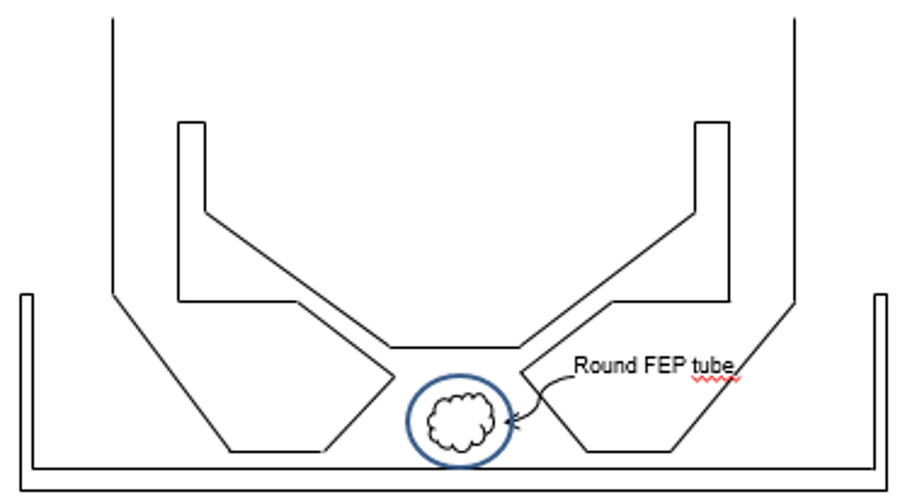
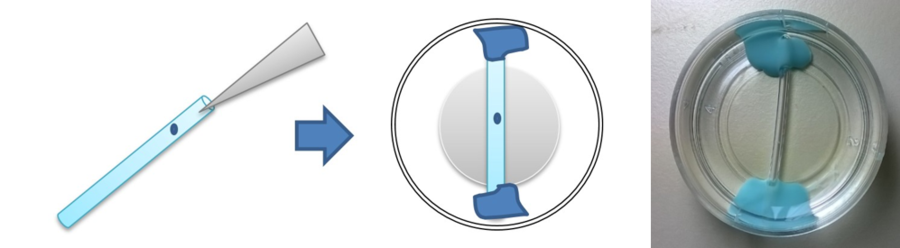
这种标本安装方法的优点包括:
- 处理方便和
- 可以使用低浓度的支架介质(如琼脂糖或甲基纤维素),在生理条件下提供足够的样本稳定性,适合长期体内成像。
然而,这种方法的缺点是标本的对齐难度较大,尤其是在需要将感兴趣区域暴露于用于荧光检测的侧面时。
为了克服这一缺点,同时保持上述优点,设计了一种旋转装置,允许轻松调整 FEP 管的角度,以便样本能够最佳对齐进行成像。这种设置在其他研究中已得到验证 [1, 2, 3]。
用于 DLS 成像的样本旋转装置(编号 158007064)包括:
- DLS旋转装置;
- 显微镜玻璃盖玻片(21 x 26 毫米);以及
- FEP 管(Camitec,外径 2.00 毫米,内径 1.80 毫米)。
然而,旋转装置中不包括用于密封盖玻片的硅胶或其他材料。
第一步:清洁 FEP 管(推荐程序)
如 Kaufmann 等 [4]报告中所述,FEP 管在使用前应按以下方式处理:
- 首先,所有溶液必须去气并用注射器过滤(Millex-HV,PVDF,0.45 µm);
- 用 1 M NaOH(Merck)冲洗;
- 将其放入 0.5 M NaOH 中超声处理 10 分钟;
- 用双蒸水和 70%乙醇冲洗
- 在 70%乙醇中超声处理 10 分钟;
- 用双蒸水冲洗;并且
- 最后,存放在双蒸水中。
第 2 步:用玻璃盖子密封旋转装置
将盖玻片密封到旋转装置上的方法如下:
- 在旋转装置底部凹槽的内缘涂抹硅胶(见下方 A);
- 添加盖玻璃并轻轻按压玻璃,以确保其均匀贴合,以便在所有点上形成良好的密封(见下方 B);并且
- 检查腔体密封,向旋转装置中添加一些蒸馏水,看看是否出现泄漏(见下文 C)。