摘要
一些最常见的神经退行性疾病,包括阿尔茨海默病(AD)和帕金森病,的特征是受影响脑组织中出现局部病理结构,以及相应的神经症状逐渐加重。这些组织病理的一个共同特征是,它们通常涉及异常折叠蛋白和相关的富含脂质结构的复杂聚集体 [1–4]。然而,尽管经过数十年的深入研究,这些疾病的分子机制仍然未完全理解,目前尚不清楚观察到的组织病理是疾病的原因还是结果。
因此,能够提供越来越详细的生化和生物物理特征描述的脑组织病理结构的方法需求量很大。在最近的一篇预印本 [4]中,我们展示了受激拉曼散射(SRS)显微镜在提供对阿尔茨海默病小鼠模型中病理性淀粉样β(Aβ)聚集体与相关脂质种类之间相互作用的独特见解的潜力。特别是,我们展示了一种双色 SRS 程序,能够在脑部大量健康蛋白质内容中清晰、无标记地可视化病理性 Aβ聚集体。此外,SRS 光谱成像允许对脑脂质进行详细的空间分辨分析,并展示了在健康和病变脑结构中几类相关脂质的明显差异定位。
在接下来的内容中,我们提供了结果的简要总结。如需进一步详细信息,请随时参考公开的完整手稿 [4]。
结果
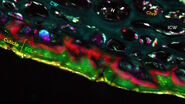
来自携带淀粉样前体蛋白和前蛋白酶 1 突变的小鼠的未标记脑切片,表现出类似阿尔茨海默病的病理特征 [5,6],以及来自健康对照小鼠的切片,由我们在德国神经退行性疾病中心(DZNE,德国波恩)的合作伙伴提供。使用莱卡显微系统的 SP8 CARS 显微镜和 SRS 附加装置进行了相干反斯托克斯拉曼散射(CARS)显微镜和受激拉曼散射(SRS)实验。额外的非线性光学信号(2 光子自发荧光、二次谐波生成)也同时获取。图 1 显示了皮层和海马区域及交织的白质区域的大面积 SRS 图像。在这里,脂质的分布通过 2850 cm⁻¹处 CH₂伸缩振动的 SRS 信号可视化。因此,富含脂质的结构显得明亮,例如胼胝体(CC)的白质束和遍布皮层(C)的单个髓鞘神经元,而缺乏脂质的结构,如神经细胞核,则显得较暗。此外,图 1 还显示了皮层中大量局部富含脂质的结构,这些结构仅在病变脑切片中可见。接下来,我们将展示这些结构对应于与淀粉样蛋白斑块相关的病理脂质沉积。

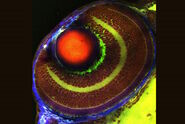
为了研究阿尔茨海默病的病理而无需荧光标记,我们首先设计了一种双色 SRS 程序,以特定可视化病理性 Aβ聚集体与大脑中的健康蛋白质和脂质成分(图 2)。为此,我们利用了由于肽的错误折叠而产生的 Amide I 模式的频率偏移,这种情况在 Aβ肽的聚集形式中是常见的。通过取 1675 cm⁻¹(“错误折叠”Amide I 模式的峰值)和 1665 cm⁻¹(“常规”Amide I 模式)的 SRS 对比率,我们能够在脑组织中获得 Aβ聚集体的清晰特征(图 2 右侧面板)。
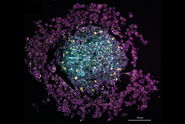
这种比率的淀粉样β标志与已知的 2850 cm⁻¹处脂质对比的结合,使我们能够研究脂质与病理性淀粉样β聚集体的共定位行为。如图 3 所示,我们发现 Aβ聚集体的核心始终被显著的光环状脂质丰富沉积物包围。健康的脑切片在皮层中既没有显示 Aβ聚集体,也没有显著的局部脂质沉积。

观察到的脂质沉积在形态上是复杂的,由多个不同特征组成,大小范围从几微米到十微米不等。这些结构中有些呈现出类细胞的外观,具有凸形状和一个包含较低脂质浓度的圆形中央核心,类似于细胞核。有趣的是,早期的荧光显微镜研究表明,微胶质细胞/巨噬细胞可以被招募到 Aβ斑块中。
观察到的脂质结构与 Aβ聚集体的关联特别引人注目,因为最近的假设表明,某些类别的脂质可能通过影响神经毒性 Aβ物种在大脑中的运输,在阿尔茨海默病的进展中发挥作用。因此,我们决定使用 SRS 光谱成像(也称为超光谱 SRS 成像)更详细地研究这些脂质沉积的生化成分。图 4 中显示了代表性的 SRS 图像和光谱。
病理脂质沉积的 SRS 光谱在图 4 中以绿色显示。为了进行比较,脂质丰富的健康白质、富含蛋白质的灰质和神经核的光谱也一并展示。特别是指纹区域(1800-500 cm⁻¹)提供了丰富的光谱内容,使得对组织的详细生化特征化成为可能。白质和病理脂质结构均显示出高浓度的不饱和脂质(1665 cm⁻¹),但几乎没有脂质氧化的迹象(1750 cm⁻¹处的酯基信号几乎缺失)。在 900-1400 cm⁻¹范围内的进一步特征将允许对脂质进行更详细的指纹识别,然而,这一分析因该范围内也存在的蛋白质信号背景而变得复杂。令人惊讶的是,700 cm⁻¹附近的信号虽然看似微弱,但仍包含关于几种高度相关脂质种类的重要信息。该区域在图 5 中进行了详细检查。

放大后的 650-790 cm⁻¹区域的光谱,如图 5 所示,揭示了许多特定于脂质的共振:在 705 cm⁻¹处发现的甾醇环呼吸模式表明,胆固醇在健康白质中浓度很高(图像顶部),但并未显示出与 Aβ斑块相关的脂质沉积的明显特定定位(图像底部)。相比之下,膜磷脂,如磷脂酰胆碱和神经酰胺(通过 725 cm⁻¹处胆碱基团的振动可视化),在斑块相关的脂质沉积中高度富集。磷脂酰乙醇胺(765 cm⁻¹),大脑中的另一种显著脂质,分布较为弥散,似乎在阿尔茨海默病病理中并未发挥明显作用。
讨论
脂质与病理性 Aβ结构的相互作用正在积极研究中,因为它们与阿尔茨海默病(AD)进展的相关性。这项研究的原因在于,脂质被认为能够以类似洗涤剂的方式从较大聚集体中提取小的 Aβ寡聚体,从而促进神经毒性,而这种神经毒性被认为仅源于小的 Aβ寡聚体。此外,几种主要脂质类别(包括胆固醇)的异常代谢或运输已知与 AD 相关。
我们对 Aβ斑块附近脂质沉积的光谱分析揭示了这些病理结构中重要脂质种类的明显差异定位:与斑块相关的沉积富含膜脂质磷脂酰胆碱和神经酰胺,但胆固醇的含量远低于附近健康的富脂脑结构。这些观察为斑块相关脂质的来源提供了重要线索,表明附近神经突起的膜更可能是来源,而不是与异常胆固醇运输相关的潜在替代机制。一些脂质结构似乎在形态上与小胶质细胞/巨噬细胞相似。因此,未来研究的一个有趣方向是调查大脑的先天免疫系统是否在招募脂质种类到神经退行性变的部位中发挥作用,以及这些机制是否可以被利用来对抗疾病。
综合来看,我们的结果突显了 SRS 在更广泛地深入理解神经退行性疾病方面的潜力 [1–4,7,8]。未来,我们预期 SRS 的光谱成像能力将使其在生命科学和医学的许多领域实现类似的应用。这些领域从细胞和组织生物学的基础研究到疾病机制的临床前研究,再到组织病理学和诊断成像的应用,以及识别广泛疾病的新型生物标志物。
参考文献:
- Kiskis, J. et al. Plaque-associated lipids in Alzheimer’s diseased brain tissue visualized by nonlinear microscopy. Sci. Rep. 5, 1–9 (2015).
- Shahmoradian, S. H. et al. Lewy pathology in Parkinson’s disease consists of crowded organelles and lipid membranes. Nat. Neurosci. 22, 1099–1109 (2019).
- Ji, M. et al. Label-free imaging of amyloid plaques in Alzheimer’s disease with stimulated Raman scattering microscopy. Sci. Adv. 4, eaat7715 (2018).
- Schweikhard, V., Baral, A., Krishnamachari, V., Hay, W. C. & Fuhrmann, M. Label-free characterization of Amyloid-β-plaques and associated lipids in brain tissues using stimulated Raman scattering microscopy. bioRxiv 789248 (2019). doi:10.1101/789248
- Jankowsky, J. L. et al. APP processing and amyloid deposition in mice haplo-insufficient for presenilin 1. Neurobiol. Aging 25, 885–892 (2004).
- Schmid, L. C. et al. Dysfunction of Somatostatin-Positive Interneurons Associated with Memory Deficits in an Alzheimer’s Disease Model. Neuron 92, 114–125 (2016).
- Poon, K. W. C. et al. Lipid biochemical changes detected in normal appearing white matter of chronic multiple sclerosis by spectral coherent Raman imaging. Chem. Sci. 9, 1586–1595 (2018).
- Tian, F. et al. Monitoring peripheral nerve degeneration in ALS by label-free stimulated Raman scattering imaging. Nat. Commun. 7, 13283 (2016).