大视场和高放大倍率
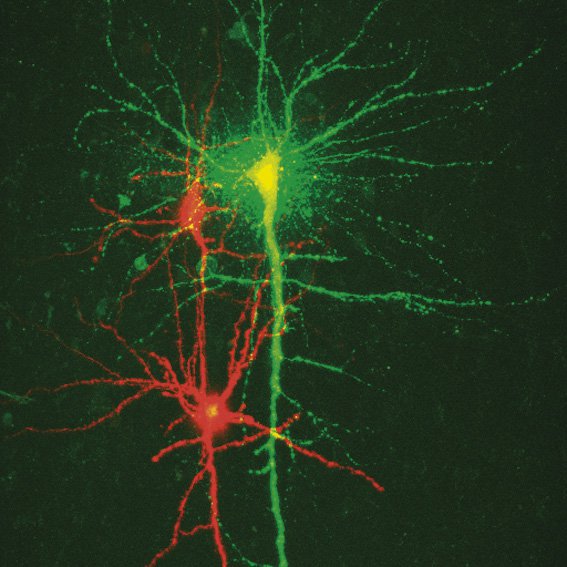
在膜片钳实验中,玻璃微管与细胞膜之间形成紧密的密封。这种排列方式允许记录与神经元和其他细胞活动相关的微小电流和电压(图1)。为了在样本中找到感兴趣的区域(例如活体小鼠的大脑、活体脑片、胚胎等),需要一个大的观察视场。此外,能够可视化详细结构以精确放置样本中的吸管和电极也非常重要。
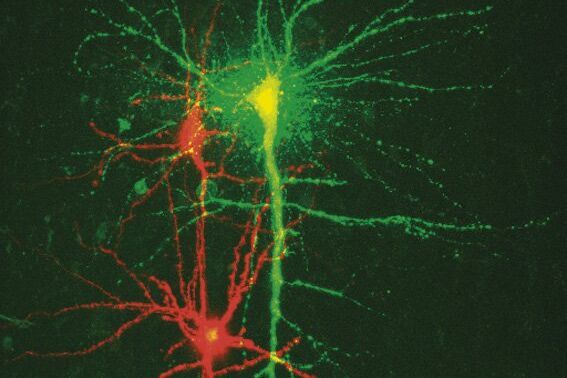
徕卡 DM6000 CFS 结合了新的高NA/低放大倍率物镜HC X APO L20x/1.0 W和CCD相机模式中的放大倍率切换器。这种组合可以在保持大观察视场的同时快速概览样本。此外,通过使用不同的放大倍率切换器,可以轻松改变观察视场。使用20倍物镜可以获得大视场。为了识别单个细胞,可以使用4倍放大倍率切换器。因此,通过同时使用物镜和放大倍率切换器,可以轻松将吸管放置在靠近细胞的位置(图2)。如果需要更高的分辨率,例如研究神经突触,系统可以切换到共聚焦扫描模式。
单细胞电穿孔
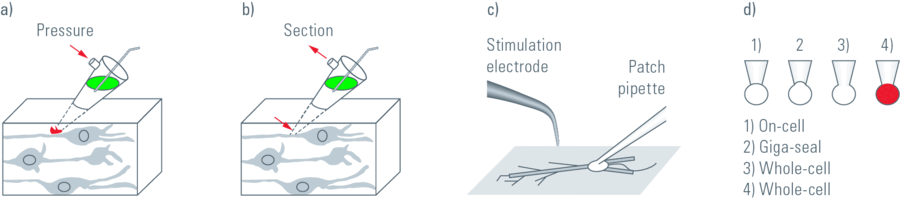
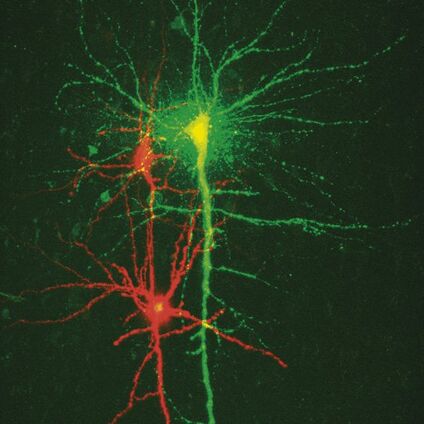
为了研究脑中的神经网络,需要对单个细胞进行特定标记。一种称为单细胞电穿孔的新方法(Nevian和Helmchen,2007)可以快速选择性地加载细胞。传递短暂的电压脉冲,使电磁场作用于细胞膜。这导致短暂形成小孔,这些孔在几秒内关闭。在孔的打开过程中,带电分子沿电化学梯度方向运输。该方法可用于使用钙敏感染料和其他染料加载神经元(图3)。
与使用胞内记录电极或膜片钳进行加载相比,使用单细胞电穿孔技术背景染色较低。单细胞电穿孔技术特别适用于离体和体内亚细胞Ca2+动力学的功能成像。可以同时加载多种物质以获得形态和功能测量数据。此外,可以顺序加载多个细胞,以使用同一吸管成像小的神经网络。
关联光学和电学数据 – 图像的同步显示
在许多生理应用中,细胞对不同类型的刺激的反应是研究的重点。需要以同步的方式测量和显示细胞的电学和荧光强度数据。强度数据通常指胞内钙浓度或pH值。Leica DM6000 CFS可以实现电学和光学数据的同步相关;电压记录与荧光强度数据同步相关,并自动显示在图表中。这样可以快速直观地了解实验进展情况并进行在线数据评估。此外,图像显示在图表下方,以快速获取有关细胞形态的信息。
数据采集盒和Leica触发单元是查看强度和电压数据相关性的重要组件。通常会将记录的信号(如来自神经元的信号)放大,然后发送到国家仪器(National Instruments)的NI数据采集盒(DAQ盒)进行信号数字化处理。DAQ盒连接到触发单元,允许与扫描过程同步。它还连接到计算机,以便显示相关的光学和电学数据以及图像。
心肌细胞中的电流和钙离子
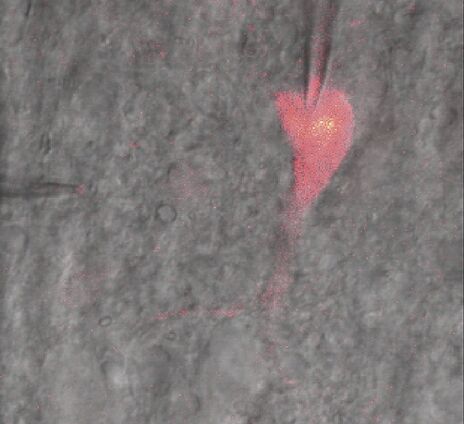
使用钙敏感染料Fluo4标记的鳟鱼心肌细胞通过膜片钳(HEKA EPC-10 double)的触发脉冲方式进行刺激。使用荧光成像和电学记录测量心肌细胞对胞内钙浓度和离子电流的反应。膜片钳设置上的刺激协议与共聚焦时间序列同步,使用膜片钳设置上的触发器在时间轴上标记单个帧中的事件。记录线触发器以确保图像扫描、荧光信号强度和细胞的电学反应的精确相关性(图4)。这些触发器由扫描头自动生成。这意味着每次扫描一条线时,相应的触发脉冲将被记录并显示在量化图表中。使用Leica DAQ盒实现图像和触发脉冲的同步。
多光子显微镜和外部检测器
在生理应用中研究组织深层细胞是一个重要挑战。多光子显微镜提供了解决这一挑战的几个优点。较低的光散射、受限的激发和漂白到焦平面以及降低的光毒性是多光子显微镜的特性,使其能够可视化深层结构。例如,脑片具有很高的散射性,并且通常切割成数百微米厚度。因此,使用标准共聚焦显微镜对脑片进行成像非常困难。而使用多光子显微镜可以对较厚的样品进行成像,因为光子收集效率得到提高。
在共聚焦显微镜中,针孔光阑会拦截失焦的荧光光以及散射(扩散)光。由于检测器无法“看到”散射光,因此很难成像散射光强的组织,例如厚脑片。然而,在多光子显微镜中,不需要共聚焦针孔来拦截失焦光,因为所有荧光光源都来自焦点。样品发出的光不需要再次穿过显微镜。因此,检测器可以尽可能靠近样品,以便收集散射光子。通过这种方式,与共聚焦显微镜相比,可以实现显著更高的光子收集效率。
外部非下放检测器(NDDs)是用于收集聚焦和散射光的光电倍增管(PMTs)(图5)。NDD是包含用于检测两个或四个不同荧光信号的PMT的盒子(4通道NDD)。为了分离信号,可以使用几个滤光片盒,并将其放入检测器盒中。
荧光和高对比透射光成像
厚脑切片中的未染色神经元是相位对象。为了使它们可见,需要将它们的相位梯度转化为幅度梯度。有不同的方法可以实现这一点。其中一种方法是使用差动干涉对比(DIC),这需要在光束路径中使用棱镜和偏振滤光片。因此,当同时成像透射光和荧光时,由于光路中的光学元件,光子收集效率降低。
红外扫描梯度对比(SGC成像)-也称为Dodt对比-是用于可视化厚散射组织中未染色细胞的另一种方法。这是由Hans-Ulrich Dodt(德国慕尼黑马克斯-普朗克研究所)开发的一种特殊光学系统。在这种技术中,可以特别调整对比度,以突出不同的结构(水平或垂直)。
使用Dodt梯度对比方法,在光路中不需要光学元件即可获得高对比度和高分辨率图像。在显微镜台和灯箱之间的透镜系统重新成像了准直器的孔径平面。空间滤波由位于照明光束中的四分之一环执行。环后面放置了一个扩散器,用于在准直器孔径上产生斜向照明。光阻挡了大部分照明光,只有一部分照明光锥被使用。因此,在切片中产生较少的散光,并且可以使用油浸准直器(例如1.4 NA)进行高分辨率成像。可以调整空间滤波器的方向和扩散器与空间滤波器之间的距离。
Dodt梯度对比产生的对比度非常强,图像看起来类似于DIC图像。Dodt梯度对比图像由透射光检测器或称为Dodt检测器检测到。Dodt检测器的光电倍增管(PMT)对红外光的灵敏度更高(最高可达约900 nm),与常规PMT相比。当使用红外激发时,配备NDDs和Dodt检测器的Leica DM6000 CFS系统可以同时检测荧光和透射光。由于光路中没有光学元件,它提供了最高的光子收集效率。这也有助于许多生理学应用,例如光引导的膜片钳实验(图6)。NDDs还适用于检测二次谐波产生信号(SHG)(图7)。当使用红外激发时,Dodt梯度对比可以在相机和扫描模式下工作。它也可以在可见光激发下使用,但对比效果可能不太显著。