Watanabe博士,非常感谢您抽出宝贵的时间谈论您的研究。您正在从基本功能着手研究脑功能。了解膜动力学被认为在这些研究中是至关重要的——你能解释为什么吗?
大脑的基本单位是神经元。神经元在我们的大脑中形成一个网络。神经元之间的接触部位称为突触。为了进行交流,神经元在这个接触部位发出信号。含有化学信号或神经递质的突触囊泡与膜融合释放神经递质。如果没有这个过程,你就不会在神经元之间有任何交流,因此你不能思考或你不能移动。因此,突触处的膜动力学对我们的生命至关重要。
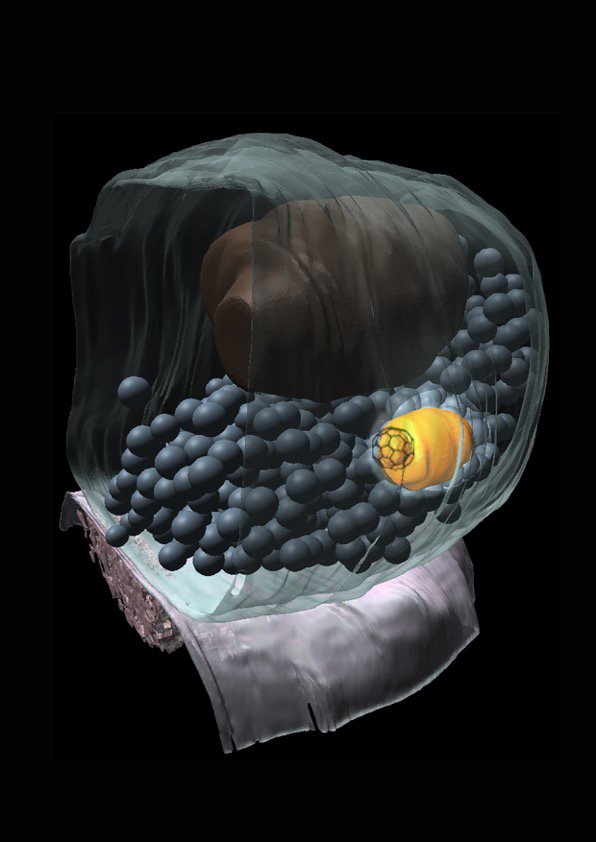
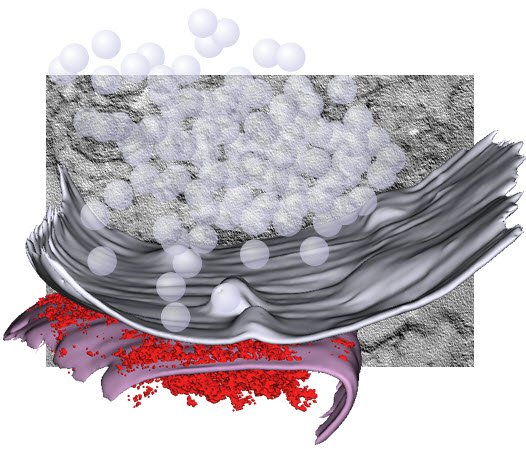
事实证明,突触末梢只有大约300个囊泡,但你可能每秒使用超过100个囊泡。所以你就会在几秒钟内把末梢上的所有囊泡都耗尽。在正常情况下,您在几秒钟内将无法再思考或移动。但事实显然并非如此。神经元能够再循环突触末梢的囊泡。
有许多蛋白质在突触末梢行使功能,对突触囊泡中的这些过程、融合或再生进行调节。而这些蛋白的缺陷与许多神经系统疾病有关。了解这些蛋白质的正常功能,并找出当这些蛋白质有缺陷时出现的问题,使我们能够了解这些神经系统疾病的发病机制。
你是否已经因为你所做的工作和你所取得的成果而对神经系统疾病有了更深入的了解?
是的,在某种程度上可以这样讲。我们确实了解了一些蛋白质的功能,例如与帕金森病相关的突触核蛋白。直到最近,人们还不知道它们是如何调节囊泡融合过程的。
我们现在有数据表明,与唐氏综合征有关的突触小泡磷酸酶在突触末梢再生突触囊泡。我们开始了解一些蛋白质在细胞中的作用,我们了解突变或基因复制对突触功能的作用。然而,我们对整个神经系统疾病远不够了解。
根据您目前的研究结果,您将如何对神经系统疾病进行分组?
其实我们更多的是在基础科学家的角色上。我们喜欢去了解突触通常做什么。因为如果我们理解正常情况下突触是做什么的,我们就能够重建如果你在这个过程中有缺陷会发生什么。我们从基本认识到拟合部分发病机制。总之这是一个大的飞跃。这些疾病不会是一件简单的事情。
目前一些科学家认为细胞中的金属(例如铁)聚集会导致神经退化。您是怎么发现这些效应是在起作用的?
这是一个有利的假设,即蛋白质的可溶性和聚合形式之间存在相变。
如果您观察患者,例如阿尔茨海默病,您会发现很多聚集物遍布大脑的各个地方,但即使在发病机制中,发生的第一件事就是突触功能障碍——突触末梢发生一些变化并进一步改变了突触传递的特性。
...这正是您的研究领域。有一系列方法用于研究细胞,您在研究过程中使用了哪些技术?
我们应用了许多细胞生物学方法来观察蛋白质,但我们做的基本试验是通过电子显微镜完成的。这也是将我们的研究与外地领域的研究分开的原因。我们在使用电子显微镜作为研究突触功能的主要工具方面非常独特。
其原因是突触如此之小,突触末梢内的所有细胞器都聚集在一起,电子显微镜是唯一可以显示单个囊泡的方法。即使随着超分辨率显微镜的出现,实际上也不能描绘突触末梢中的每个囊泡。传统的电子显微镜有一个大问题:你只能用固定的样品工作。但现在通过光刺激,我们可以同步神经元的活动并跟踪膜动力学。
因此,我们所做的是在细胞中表达视紫红质通道,并用光刺激神经元。然后我们在刺激后规定的时间点冷冻细胞。这实际上产生了膜动力学的翻译本,该技术被称为“急速冷冻”。我们可以使用这种技术来可视化突触实际上在做什么。
也就是说“你在思想发生的时候冻结思想”是否合适?
是的。因此,我们在发送信号的同时冻结神经元。但是(笑)我不知道培养皿中的神经元是否有思想。
您是否可以比较您用于停止移动活细胞成像的方法,与使用闪光和冷冻过程的电子显微镜和“生命”采样相比,省略了正常分辨率的缺点?
从技术上讲,我们并不是在观察活体样本。它们是被冷冻的。但由于实验过程中对每个时间点的确切掌控,我们相对应仍然看到了动态过程。
您认为您的研究将来会朝哪个方向发展?
我们实验室正在进行几项研究,但在多数情况下我们对了解突触的细胞生物学非常感兴趣。显然,一个有趣的方面是研究超快内吞的分子机制。这一现象是我们发现的。我前面提到的那些蛋白质似乎对这一过程的调控非常紧密。
我们要深入研究的另一个方面是受体贩运。神经递质释放后,由突触后表面的受体接收并进行信号传递。突触后细胞表面这类受体的数量被认为是理解这些机制的重点。事实上这一数量的变化依赖于经验。因此,我们对观察这种变化是如何在突触传递过程中发生的非常感兴趣。