引言
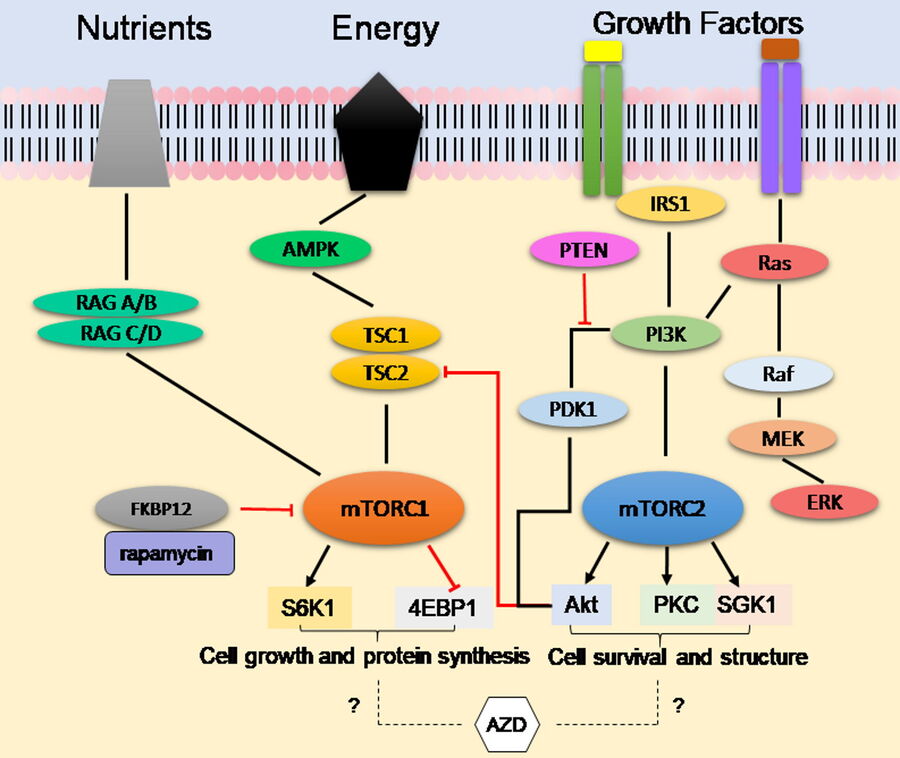
哺乳动物雷帕霉素靶蛋白(mTOR)通路通过磷酸化事件将细胞的营养物质可用性、生长因子和能量状态与下游靶蛋白的激活相协调 [2]。在这个级联信号通路中,这些下游底物负责调节细胞增殖、蛋白质合成、自噬、衰老和凋亡等功能。mTOR蛋白存在于两种复合物中(图 1):复合物1(mTORC1)和复合物2(mTORC2)。mTOR蛋白的广泛功能使其成为与mTOR信号功能障碍或过度激活密切相关的疾病(如癌症)中的有吸引力的药物靶点。
第一代mTOR抑制剂,如雷帕霉素和临床上批准的类似物(rapalogs),尽管最初在以前的临床前模型中显示出有效性,但结果证明只能部分抑制mTOR复合物1。最近的研究表明,肿瘤对第一代mTOR抑制剂产生了rapalog抗性,并且在少数类型的癌症中表现出有效性。由于mTORC2直接磷酸化Akt(涉及细胞存活的重要蛋白),因此很可能需要同时抑制这两个复合体才能有效治疗癌症。
新型第二代ATP竞争性抑制剂,如AZD2014,通过靶向mTORC1和mTORC2提供了更好的抗肿瘤活性 [3]。尽管AZD2014目前正在积极进行临床试验,但其作用模式未知。为了研究AZD2014的工作机制,利用其天然存在的荧光特性及其在活细胞球中的定位,使用数字光片(DLS)显微镜观察活的3D细胞培养模型环境中AZD2014的细胞摄取 [4]。
材料与方法
为了研究细胞球环境中的AZD2014,将HEK293细胞以每孔10,000个细胞的密度培养在96孔圆底板(U型孔)中。在37°C和5% CO2条件下培养细胞72小时后,HEK293细胞自组装成细胞球。然后,将这些细胞球转移到35毫米玻璃底培养皿中的低熔点琼脂糖支架上,每个培养皿包含能够容纳多达5个细胞球的孔。使用定制的3D打印梳子在琼脂糖中铸造孔 (图 2B)。在装载完所有5个细胞球后,用完全生长介质填充玻璃底碟,然后将其放置在显微镜上。
加入AZD2014(最终AZD2014浓度为7μM)后,在37°C和5% CO2条件下对样品进行成像。使用TCS SP8 DLS显微镜获取细胞球的3D延时图像 (图 2E)。为了监测药物在细胞球内的摄取情况,在2小时内每15秒记录44个平面(xyz堆栈的尺寸为780μm×780μm×300μm)。
用10×/0.3数值孔径(NA)的检测物镜获取体积,其视场为735μm×735μm。为了生成数字光片,使用2.5×/0.07NA物镜和405纳米激光,得到3.7μm的光片厚度和240μm的瑞利长度。
使用两个反向传播的光片,以减少由于样品厚度引起的光散射导致的图像退化以及减少条纹效应。这可以通过利用徕卡显微系统独特的 TwinFlect 反射镜 设计来生成光片来实现。每次用一个光片获取每一帧,并合并为一个单一图像。

图2:细胞球播种、安装和成像过程。A)将HEK293细胞以每孔10,000个细胞的密度接种到96孔圆底(U型孔)板中,预先用100µl的1.5%琼脂糖浇铸,在完全生长培养基中最终体积为200µl。B)用于在成像实验期间在琼脂中创建容纳细胞球的孔的3D打印梳子。C)然后将细胞球转移到孔中。白色圆圈显示孔中的单个细胞球。D)面板中圆圈内细胞球的放大视图。E)徕卡数字光片荧光显微镜的原理,光片在两个反射镜之间产生,细胞球置于其中。F)细胞球通过光片移动并进行光学切片。图取自Ahmed等人 [1]。
结果
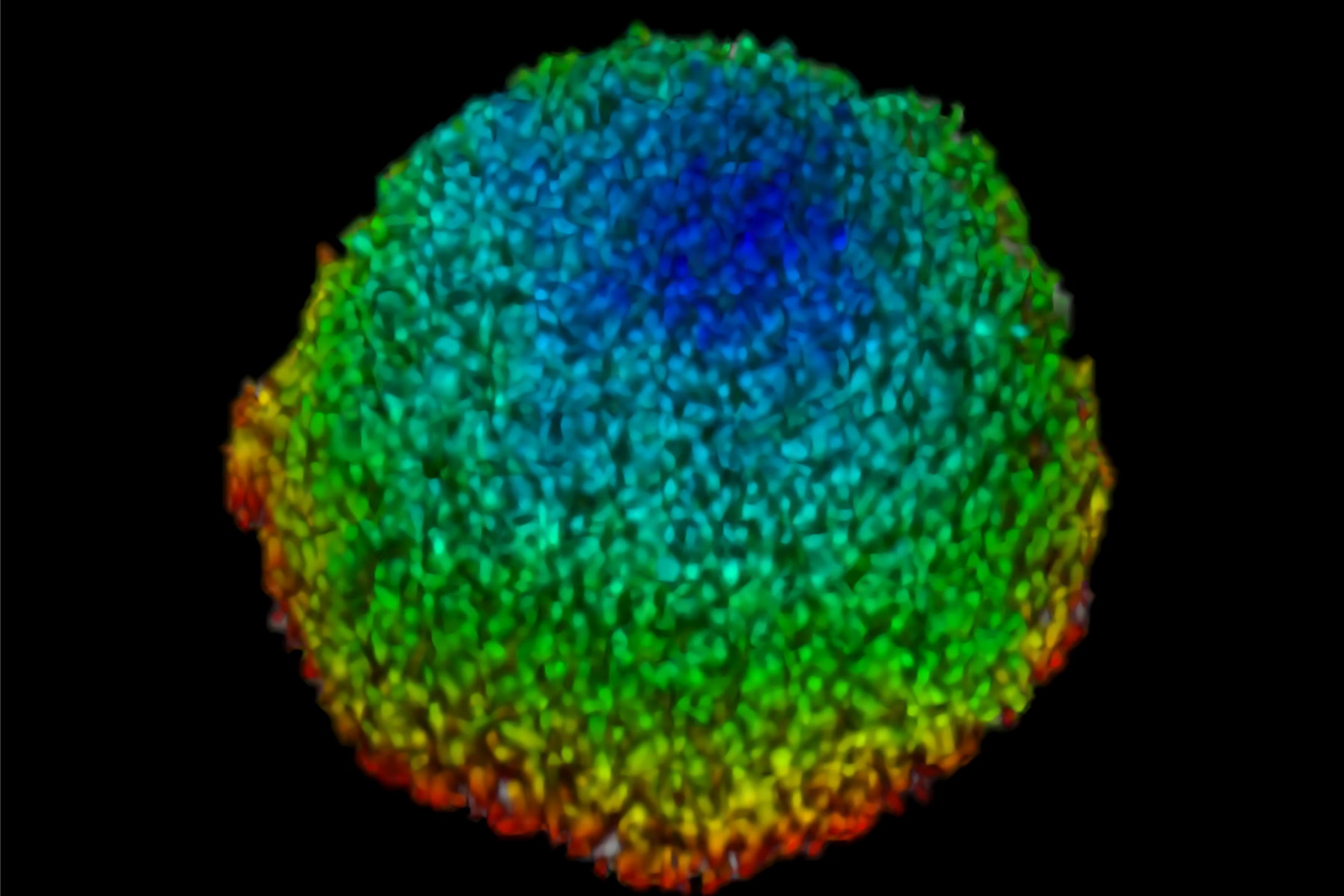
本研究首先通过表征其在细胞球3D细胞培养模型中的摄取来检查AZD2014在肿瘤环境中的作用。加入AZD2014后,可以观察到AZD2014固有荧光明显增加。细胞球的外层比细胞球内核的摄取速度更快 (图 3). 通过观察相对于细胞球表面在三个选定深度[0µm(表面)、100μm(内层)和200μm(深层)]的不同摄取率,这一点变得明显。
这些深度的摄取速率分别为添加后的80、200和318秒。此外,在暴露于AZD2014(7μM)30分钟后,可以看到细胞球的平均半径增加25%(标准偏差=±0.019%)。只有当样品上同时存在药物和405纳米的照射时,才会出现尺寸增加。这一发现表明这种分子具有独特的、以前未知的光活化特性。

图3:AZD2014在3D多层细胞球中的摄取。A)AZD2014给药和HEK293细胞球的成像。显示了不同的xy平面或深度(行)以及正交投影(xz平面)。B)在2小时的时间跨度内研究了球状体中AZD2014荧光的摄取速率在不同深度。C)在给予AZD2014成像期间细胞球半径的增加。在给药后30分钟至2小时的不同时间点显示深度为250µm的图像平面。D)在不同深度上AZD2014摄取的平均速率。E)图表显示与AZD2014+405nm照射、仅405nm照射或仅药物相比,细胞球半径的相对增加。图取自Ahmed等人 [1]。
讨论
在这里,我们表明使用数字光片成像研究的3D细胞球中,AZD2014被活细胞迅速摄取,半衰期约为1分钟。此外,这种方法揭示了该分子一种独特的、以前未知的光激活特性。本出版物中提供的数据表明,AZD2014可能有潜力作为一种光激活药物,可用于抗癌光动力疗法(PDT)。
结论
能够在3D环境中非侵入性地监测药物在活癌细胞内的定位和行为,是一个非常强大的工具,有助于更好地理解肿瘤生物学,并改进癌症药物的筛选和开发。在本研究中,使用 TCS SP8 数字光片显微镜 进行成像,通过以下方式实现了对3D肿瘤球状体模型中施药细胞动态相互作用的可视化:
- 由于其设置,使用户可以无限制地接触他们的样本,这允许在本文所述的工作流程中轻松有效地递送感兴趣的药物或化合物;
- 结合温和和快速的光片成像与良好的亚细胞分辨率,允许研究动态过程,如药物摄取或活体样本的反应;
- 由于双侧光片照明和系统特定的去卷积算法,有助于像细胞球这样的3D样本的良好穿透和图像质量;
- 允许在一轮成像中对多个细胞球进行成像,从而提供了一个工作流程,在单个实验中为定量评估提供更多数据。