引言
电子显微镜,包括透射电子显微镜(TEM)和扫描电子显微镜(SEM),被广泛应用于获取生物样本或无机材料的高分辨率结构信息。超薄切片术是制备厚度小于 100 纳米的 TEM/SEM 分析用超薄切片的主流技术。在室温样品制备过程中,小块样品被包埋于环氧树脂或丙烯酸树脂中。随后通过修整去除多余树脂,并使用玻璃刀或钻石刀将样本切割成 50 纳米至 100 纳米的超薄切片。
修整过程对于去除不含样品的多余树脂、暴露样本以及创建包含目标区域或细胞以供后续切片的块面至关重要。在当前标准工作流程中,通常无法直接通过超薄切片机的标准立体显微镜识别实际目标区域,而是需要将示例性(半薄)切片进行甲苯胺蓝等染色后转移至外部光学显微镜,以判断是否已达到样本的目标平面。
为避免这些高风险且费力的转移与重新调整操作,电子显微镜学界亟需一种安全、自动化的目标平面定位方法。该方法还能使经验不足的用户安全高效地接近目标平面。
挑战
开发此类方法需应对三大挑战。首先需在树脂包埋材料中可视化目标结构;其次,需确定目标修整平面相对于参考平面的所有参数(如深度、俯仰角与偏航角)的精确位置;最后,超薄切片机需支持可视化选定目标后,根据预设参数自动完成定位切割。
本文展示了如何通过集成自动化超薄切片机 UC Enuity 的工作流程解决这些技术难题。
为用生物样本验证该方案,我们选择靶向线虫 C. elegans 体内一个明确结构——位于咽部与肠道连接处后方的咽肠阀区域(VPI,图1)。
C. elegans 样本采用高压冷冻技术制备,经四氧化锇(osmium tetroxide)轻染后冷冻置换,最终包埋于 Epon 环氧树脂中。
目标可视化
一种非破坏性技术,用于可视化树脂内部结构的方法是使用 X 射线计算机断层扫描(CT)。对于电子显微镜样本等小型样品,则采用其微型变体——micro-CT。在micro-CT 中,样品被固定在可旋转的支架上,并在特定角度下接受 X 射线照射。样品吸收并散射射线,从样品穿出的光束由探测器(如 sCMOS 相机)记录。由此产生的旋转序列图像被渲染成 3D 图像,仅通过密度和成分的细微差异,即可可视化树脂内原本不可见的结构。
此处, 秀丽隐杆线虫(C. elegans) 样本因在包埋前经四氧化锇(osmium tetroxide)固定与染色,肉眼即可在树脂块中观察到(图2)。然而,仅依靠超薄切片机上安装的立体显微镜进行三维精确定位,若不通过制作半薄切片的繁琐步骤则难以实现。此外,由于线虫体呈弯曲状且与预修整表面不垂直,手动操作极难获得目标平面的完美横截面。
预修整
在进行任何精密切片步骤前,需对样品进行修整,使包埋材料围绕样本形成特定形状以增强切片时的稳定性,并去除多余树脂以获得优质micro-CT 图像。 传统方法是在体视显微镜视觉监控下用剃须刀手动完成,最终形成的样本周围形状通常呈截顶金字塔状(图2)。对于基于micro-CT 的目标定位,这一截顶平面尤为关键,因其作为参考面用于将现实世界中的样品轮廓与软件中可视化的样品及最终目标平面对齐。
参考平面与目标平面的定义
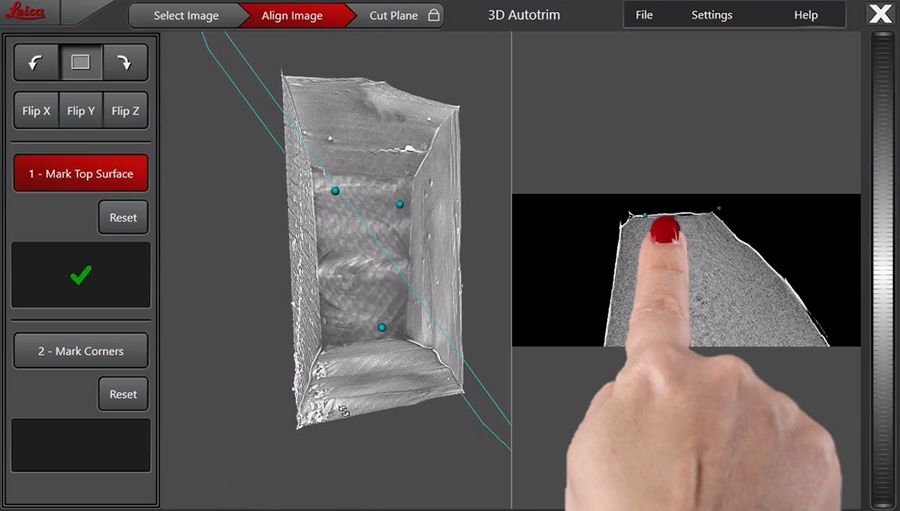
定义参考平面和目标平面时,不仅需呈现样品图像,还需选择性显示周围树脂,这有助于将超薄切片机屏幕上三维数据集选定的目标平面与实际装载的样本建立关联(图3)。Leica UC Enuity 支持加载多种格式的micro-CT 数据(例如DICOM、XRM、TIFF、JPEG等)。
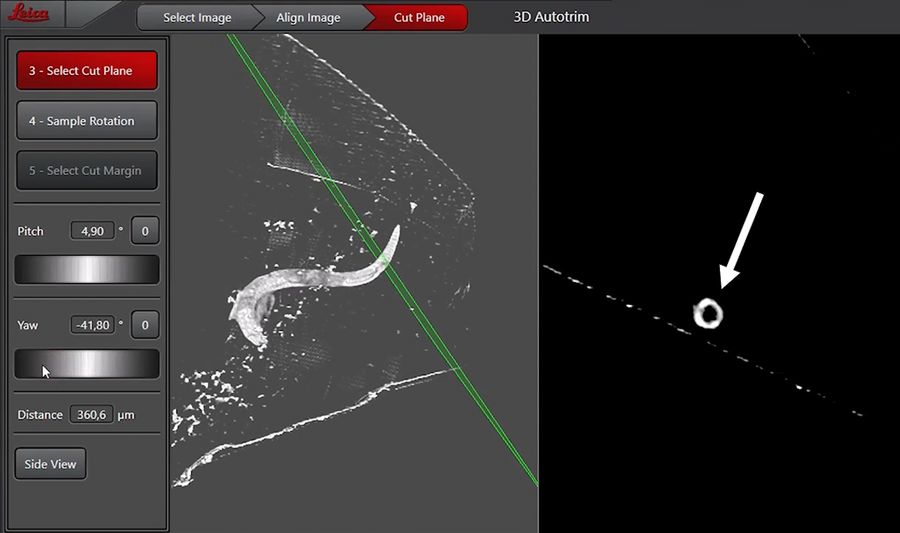
右侧显示屏展示切割平面的截面视图,便于定位目标结构。为确保到达咽部末端,我们尝试对准后球茎末端以避免丢失咽肠瓣膜。为此,我们将切割平面调整至后球茎内部,该区域在 xy 平面视图中呈现为空心结构(图5)。
自动修整
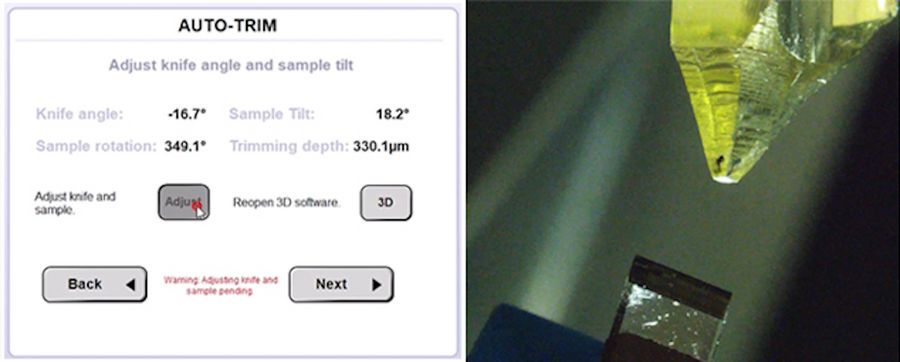
点击“调整”确认设置后,UC Enuity 将自动配置刀片角度、样品倾角及旋转角度(图6)。随后可定义修整速度与修整切片厚度并启动流程。全自动修整功能为用户节省时间,便于其准备后续步骤或处理其他事务。
在自动完成目标平面修整后,首张块面切片被截取并收集于电镜载网上。经醋酸铀和柠檬酸铅染色后,首张切片在透射电子显微镜下成像。咽部与肠道间的过渡区清晰可见,证实了采用 UC Enuity 自动化方案所设定的角度与修整深度精准无误。
摘要
本文研究表明,利用 3D micro-CT 数据结合 UC Enuity 系统,可精确定位树脂块中的特定目标平面。micro-CT 数据可导入 UC Enuity 软件交互式确定目标平面,仪器自动调节切片刀与样品参数。该方法有效减少了深度修整过程中半薄切片的繁琐迭代检查,便于按特定角度切割样品,为用户腾出时间处理其他任务。