病毒学
2020 年初,病毒学领域突然进入公众视野,原因是 SARS-CoV-2 的爆发,这是一种导致人类新型呼吸疾病的病毒。这种疾病被称为 COVID-19,导致了全球大流行。因此,进行了巨大的努力来治疗这种疾病并限制其传播。
理解这些传染性病原体的行为对于我们治疗病毒性疾病和防止进一步爆发的能力至关重要。病毒学旨在理解病毒的各个方面,包括它们的结构、演化、进入宿主细胞、繁殖、引起的疾病、宿主对感染的反应以及它们在个体之间的传播。
设计和实施有效治疗和预防措施的关键方面之一是能够可视化病毒成分及其对宿主细胞的影响。为了实现这种可视化,免疫荧光显微镜是一种有价值的方法。
免疫荧光基础
免疫荧光 [1,2] 是一种利用抗体与其抗原的结合特异性来可视化生物系统的结构和动态的方法。抗体是针对特定蛋白质产生的,或者直接用荧光标记标记,或者与荧光标记的二级抗体结合使用,以识别和研究感兴趣蛋白质的存在。
这种广泛使用且多功能的技术使科学家能够在各种背景下可视化蛋白质、细胞成分和细胞过程。例如,它可以用于研究细胞器的结构、组织中蛋白质的分布,以及在样本中染色以检测特定生物标志物的存在。免疫荧光如何在病毒学研究中发挥作用?
免疫荧光在病毒学研究中的应用
病毒是纳米级的病原体,大多数小于 0.4 微米;需要电子显微镜来观察它们的纳米结构。然而,标准和超分辨率显微镜技术是强大且易于获取的工具,可以用于理解病毒的更大规模结构和功能。
免疫荧光与多种成像方法兼容,包括标准宽场成像、共聚焦显微镜、寿命成像和超分辨率显微镜 [3-4]。选择使用哪种方法主要取决于具体应用。
诊断
使用宽场显微镜进行标准免疫荧光染色已被广泛用于通过患者的鼻咽拭子诊断流感等病毒感染。使用针对病毒特异性蛋白的抗体对感兴趣的组织进行染色,临床医生可以快速确定样本中是否存在病毒。该程序缺乏更先进的分子方法的灵敏度;然而,它快速、简单且具有临床价值 [5,6]。
感染机制
病毒的一个关键特征是它们必须进入宿主细胞才能繁殖并引起疾病。一旦它们附着在宿主细胞上,就会释放其遗传物质进入细胞。遗传物质被细胞识别并表达。编码的成分随后以多个副本的形式存在,这些副本能够组装成新的病毒颗粒。这些新颗粒由细胞释放,并可以继续感染新的宿主。因此,病毒劫持宿主细胞的机制以促进其致病效应。
理解这一复杂且高度可变的过程对于理解病毒的感染机制至关重要,尤其是像 SARS-Cov-2 这样的近期病毒。例如,免疫荧光检测已被用于研究 SARS-Cov-2 与细胞表面受体的结合动态 [7] ,以及研究其细胞内动态,包括病毒颗粒如何在细胞内组装 [8]。
对细胞功能的影响
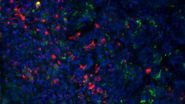
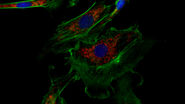
除了检测病毒入侵的存在和揭示其动态外,理解感染的发病机制也至关重要。免疫荧光技术是这些研究的重要工具,因为能够可视化细胞反应对于理解病毒疾病至关重要。这类研究可能包括细胞应对病毒感染的压力反应动态 [9],以及病毒如何影响细胞和组织修复 [10]。例如,一项研究表明,狂犬病毒感染细胞可以促进细胞质应激颗粒的形成,这些无膜动态结构由 mRNA 和蛋白质聚集体组成,能够迅速在细胞应激反应中形成 [9]。研究人员使用徕卡共聚焦显微镜。另一项研究揭示,感染流感病毒(IV)的上皮干/祖细胞的修复在很大程度上依赖于成纤维生长因子受体 2b(Fgfr2b)信号通路 [10]。 一些免疫荧光染色细胞的图像是用 徕卡正置显微镜拍摄的(参见图 1)。