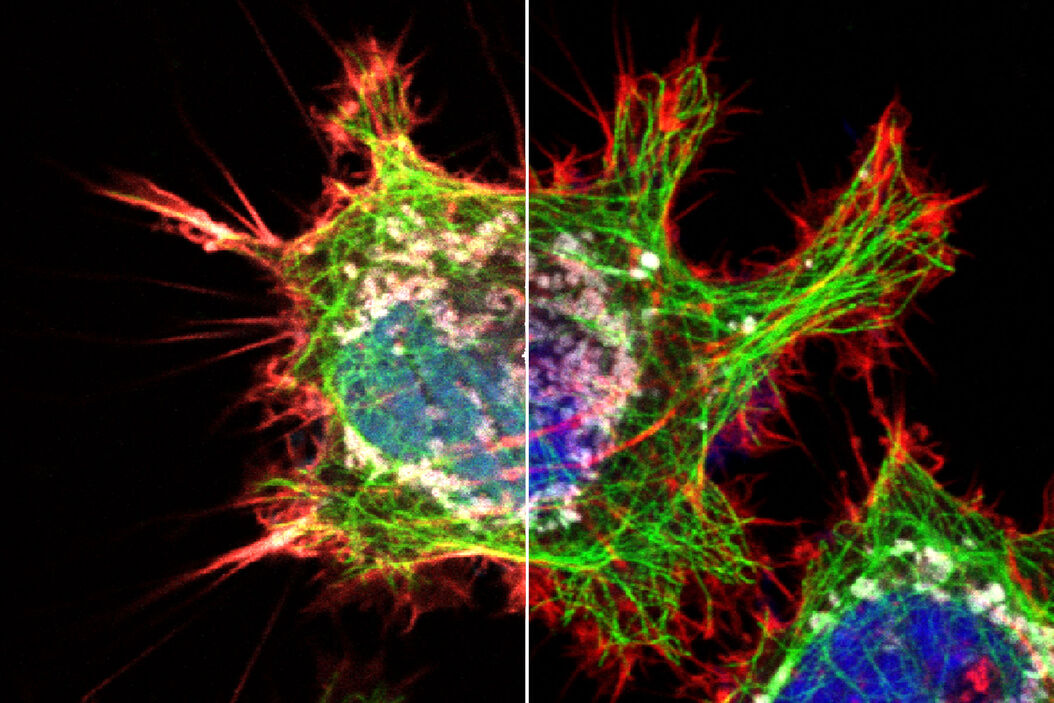
介绍
多色共聚焦显微镜是当今细胞生物学实验室中的一种基本技术。为了揭示生物系统的复杂性,需要能够同时分析样本中的多个结构、分子和微环境,并将它们相互关联。这可以通过使用不同颜色的荧光标记或生物传感器标记每个感兴趣的特征来实现,然后进行同时或顺序的多通道成像,以捕获每个探针在特定通道中的信号。然而,这种“多重化”方法的荧光染料数量是有限的。本文将深入探讨限制多色共聚焦显微镜多重化能力的一些挑战,以及改善荧光染料分离并增加可区分荧光探针数量的一些策略。
为什么多色共聚焦实验如此具有挑战性?
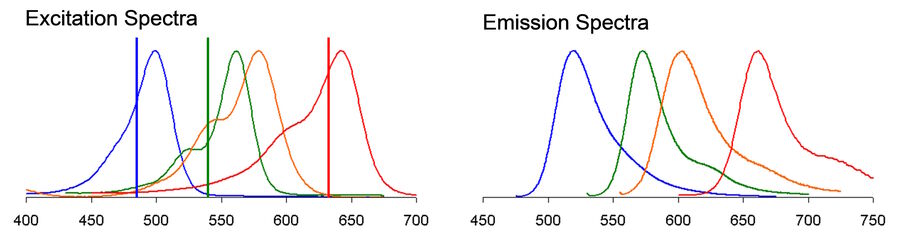
在多色共聚焦显微镜中,无法找到合适的荧光探针组合是一个常见的难题,这可能会显著延缓实验进展。导致这个问题的因素包括可用于光谱分离的荧光染料或荧光蛋白(FP)的可用性,以及共聚焦系统的限制,例如激发线、滤光片和探测器的数量和特异性。虽然有机荧光体的激发和发射峰通常在其最大高度的一半(FWHM)处宽度约为35纳米,但完整的光谱特征往往可以跨越几百纳米,包括肩部和长尾部(见图1)。考虑到可见光谱本身仅跨越约360纳米(从约380到740纳米),在多色实验中,特别是结合超过三种荧光体的实验中,光谱重叠几乎是不可避免的。光谱重叠可能导致严重的伪影,包括荧光团之间的不必要能量转移和一种荧光团的发射信号渗透到另一个荧光团的检测通道中(也称为光谱串扰或交叉)。此外,还可能遇到自发荧光和光毒性问题,这些问题使得在某些光谱区域激发染料变得不可行。
考虑一个四色实验,其中首选染料为 Alexa 488、Alexa 546、Alexa 568 和 TOTO-3(图 1)。激发线必须仔细定位,以避免在每个通道中激发超过预期的染料。这可能会带来一些权衡,例如由于偏离峰值中心而导致某些物种的激发效率低下。更重要的是,发射曲线的强光谱重叠使得避免串扰伪影成为一项挑战。因此,很难判断在受影响的图像通道中,实际上是哪个荧光染料产生了你所看到的信号。
串色的后果
为了说明串色如何影响实验结果,图 2(A)显示了仅两个荧光染料的典型激发曲线,一个绿色和一个红色。如图 B 所示,这两种染料的相应发射曲线重叠。如果样品中两种染料的发射水平不可比,重叠的相对比例可能会更显著(C)。当发射的光通过检测器(在这个假设的情况下通过带通滤光片)时,两个荧光染料的信号都在红色通道中被检测到(D)。
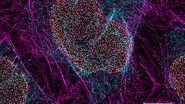
像这样的串色伪影可能导致数据解释中的严重错误,特别是在研究亚细胞荧光染料的共定位或需要定量测量时。例如,当将前面示例中的绿色和红色通道图像叠加时,会看起来好像这两种染料部分共定位,而实际上它们被分隔在不同的亚细胞区室中(图 3)。串色还可能影响依赖于强度测量的实验,例如涉及福斯特共振能量转移(FRET)或光漂白后的荧光恢复(FRAP)。

标本标记的考虑事项
在为多色共聚焦实验准备样本时,有许多重要的考虑事项和措施可以采取,以避免或减少由光谱重叠引起的伪影。
荧光染料选择
考虑是否可以用具有更窄发射峰和/或更大斯托克斯位移(激发和发射最大值之间的分离)的染料替代潜在问题荧光染料。例如,荧光量子点(QD)具有多种适合多重标记的特性,包括相对较窄和对称的发射曲线、光谱中均匀分布的多种颜色选择,以及能够使用相同激发波长同时激发多个光谱变体的能力。一些基因编码的荧光蛋白(FP)也经过工程改造以改善多重标记,例如Keima和LSSmOrange,它们具有异常大的斯托克斯位移,使得与传统荧光蛋白和化学染料结合时能够进行单次激发的多色成像。
发射强度的平衡
如果样本中荧光团的发射强度水平存在显著差异,强荧光物种的信号可能会淹没弱荧光物种的信号,从而导致特定通道中不成比例的串扰(见图2)。目标丰度、染料浓度、量子产率、光稳定性和照明强度都是可能导致发射不平衡的因素。如果样本中不同目标的丰度差异很大,明智的做法是将最亮和最光稳定的染料保留给丰度最低的目标。在样本准备过程中,荧光探针的浓度应仔细滴定。在某些情况下,这可能不可行,例如在成像表达差异调控FP物种的活细胞时。在这种情况下,可以通过使用阳性和阴性对照样本优化每个通道的激发强度,在图像采集阶段补偿不平衡。
对照样本的准备
单染色对照样本对于评估和减少在优化图像采集参数时的串扰至关重要。它们还提供了可以用于后续光谱解混的信息,并支持实验结论(例如,在发布共定位研究或定量显微镜方法的结果时)。对于活细胞检测,准备有刺激和无刺激的重复单染色样本(即阳性和阴性对照)非常重要,以便评估在预期的动态范围内潜在的串扰和其他伪影,并相应地调整采集设置。


图 3:HeLa 细胞(成纤维细胞);蓝色:Dapi,细胞核;绿色:Alexa 488,微管;红色:TRITC 鬼笔环肽,肌动蛋白;灰色:Mito Tracker Red CMXRos,线粒体。
优化图像采集以最大化光谱分离
一旦样品准备得到优化,下一步至关重要的步骤是优化采集参数。
仪器配置和采集设置
光学光路的最佳设置,包括激光器的选择、激发波长、滤光组合和检测带宽,对于最小化光谱串扰至关重要,尤其是在同时扫描期间。可能需要对仪器设置和样品准备采取迭代方法,以找到最小化伪影和实现可靠检测和定量所需的动态范围之间的理想平衡。这在活细胞实验中尤其具有挑战性,因为荧光蛋白表达水平和染料浓度可能会广泛且不可预测地变化。
顺序成像
在进行同时多通道成像时,可能会出现由于激发或发射光谱交叉而产生的伪影。在两种荧光染料的激发光谱足够分离但发射特征重叠的情况下,可以通过一次使用一个激发线的顺序成像来避免串扰。由于激发和发射特征在其不对称性上往往相互镜像,激发光谱的交叉倾向于发生在光谱的蓝端(短波长),此时峰值往往有较长的尾部,而发射光谱更可能在光谱的红端(长波长)有延伸的重叠尾部。这意味着短波长的荧光探针更可能渗透到长波长通道中,而不是反过来。因此,获取图像的顺序可能会有所不同。通常建议先用最长波长激发,然后依次向短波长工作。顺序扫描的一个缺点是,对于某些应用(例如监测活细胞中的快速动态事件),它可能太慢。此外,顺序成像无法防止在两个或多个荧光探针被同一激光线激发的情况下出现串扰。
光谱拆分算法
尽管付出了最大的努力,但在实验的前分析步骤中,可能无法防止或充分减少排放不平衡和光谱重叠。幸运的是,在图像采集后,仍然可以通过分析方法光谱分辨样品中的荧光团。为了将每个荧光团的信号数学上恢复到其各自的通道,解混算法通常基于线性解混或聚类分析方法。前者依赖于用户估计的分布或使用参考光谱来计算每个成分荧光团的分布系数。聚类分析方法提供了一个良好的替代方案。在没有光谱信息的情况下,线性解混的替代方案。与使用参考光谱不同,主要的分布系数是通过拟合确定的。
尽管光谱解混工具非常有用,但它们在样本中解析荧光探针的能力有两个主要限制。第一个限制是光谱解混受到系统中探测器数量的限制。换句话说,您无法解混超过系统能够检测的颜色。第二个主要限制是光谱解混算法无法区分相同颜色的荧光团,即那些具有相似发射光谱的荧光团。
除了光谱选项之外的寿命成像
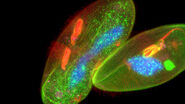
但是,如果有一种方法可以克服光谱成像的局限性,而无需向系统添加其他探测器或寻找替代的荧光染料呢?关键在于超越光谱信息的分析,增加另一个维度的分析:荧光寿命。荧光寿命是指荧光染料在发射光子之前处于激发态的时间。寿命信息与荧光强度信息是正交的,可以用来区分具有相似光谱但寿命不同的染料(图4)。最近在寿命分析技术方面的进展使得将寿命检测能力集成到共聚焦扫描头中成为可能,从而可以同时收集寿命和光谱信息。结果是能够结合寿命和光谱信息,利用基于寿命的信息区分更多的荧光染料。
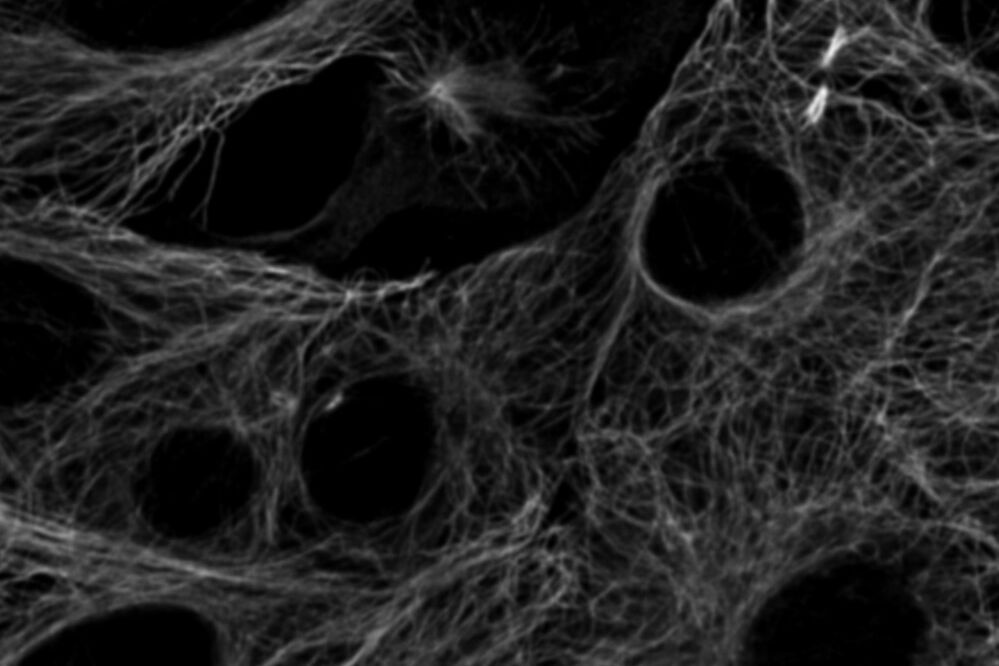

图 4:通过寿命对比区分的细胞骨架结构。