抗体是什么?
抗体是由一类名为B淋巴细胞的免疫细胞产生的免疫分子。独特的抗体基因是通过在B淋巴细胞内 发生的复杂的基因重排过程产生的。一旦这些基因表达成蛋白质,它们就会基于其与感兴趣的抗 原蛋白(如细菌细胞壁蛋白)结合的能力被选择和成熟,并履行各种下游免疫功能。
抗体在多种生物实验和环境中都有应用,因为它们可以针对实验感兴趣的特定蛋白质。更方便的是,除了由动物和人类的免疫系统产生的多克隆抗体之外,科学家们还开发了高特异性的单克隆抗体,这些抗体仅与给定抗原的一个特定表位(或蛋白质形状)结合。
抗体可以用于在实验中检测电泳凝胶上的蛋白质(免疫印迹)。此外,它们可以用于称为ELISA(酶联免疫吸附测定)的变色抗原识别试剂盒,或者直接与染料和酶进行偶联,然后直接对组织中感兴趣的蛋白质进行染色。在传统免疫组织化学(IHC)以及多重成像技术中得到广泛应用的就是这后一项功能以及其他密切相关的方法。
抗体在多重成像中是如何使用的?
由于抗体的结合特异性,许多不同的蛋白质都可以被抗体单独结合。过去,成像实验中可视化更 多标记物的障碍在于给定显微镜实际可用的荧光通道数量有限。这仍然是多重技术为达到更高数 量可视化标记物而必须克服的主要障碍。
例如,Leica Microsystems的Cell DIVE多重成像平台使用染料偶联抗体进行循环抗体染色,随后灭活这些染料以反复探测样本,从而成像更多的生物标志物。但是,也存在其他方法,如使用带有条形码标签的抗体,这些抗体仅在应用具有互补条形码的染料时才与荧光团结合。在所有情况下,都利用抗体与给定抗原的特异性结合来成像基础蛋白质。
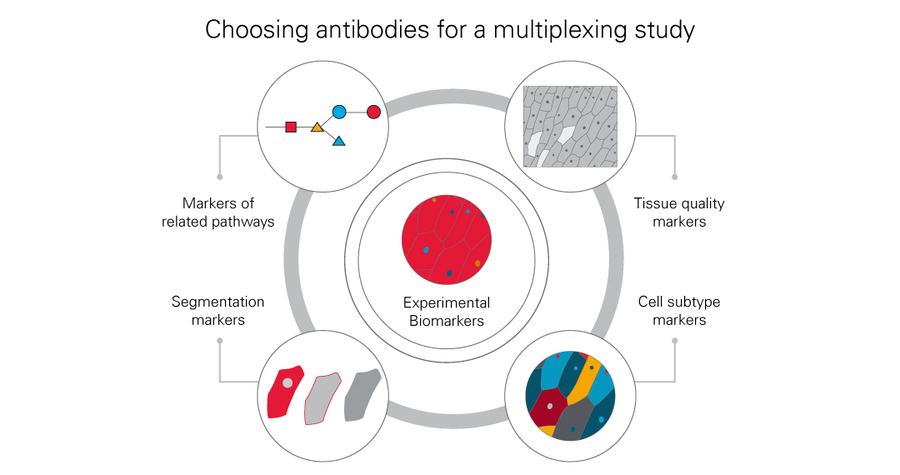
选择用于多重成像的抗体
对于给定的应用,所使用的抗体会因应用需求的不同而有所不同。例如,在免疫印迹中有效识别 蛋白质的抗体在免疫组织化学中可能并不同样有效。某些多重成像技术也可能对抗体施加进一步 的限制,例如必须能够耐受某些标签或染料结合。重要的是要彻底调查所选的多重成像方法,并 仅选择满足该方法要求的抗体。
样本类型的选择和制备也会影响抗体的选择。例如,在处理人体组织时,可以使用多种制备物, 如甲醛固定石蜡包埋组织(FFPE)或未固定的冷冻组织。常见的情况是,在冷冻组织上效果良好 的抗体在FFPE上可能效果不佳,反之亦然。此外,如上所述,单克隆抗体和多克隆抗体都是可用的。一般来说,由于单克隆抗体具有更特异的抗原结合特性和较少的非特异性结合,因此更受青睐。
例如,对于像Cell DIVE这样的开放式多重成像方法,首选的抗体是那些在FFPE组织中经过验证 且适用于IHC应用的抗体。
选择研究中的生物标志物靶点
多重成像为在研究中使用更多生物标志物打开了大门,而这是传统成像方法无法实现的目标。可用抗体的“配额”因此大很多。不过,选择抗体时同样需要小心谨慎,确保在实验上消耗的时间和精力获得最大的投资回报。
优先考虑具有直接关联的实验性生物标志物。接着寻找具有相似或相关生物通路的生物标志物,这些生物标志物可能会充实您对于实验的认识。同样要考虑图像分析的最终方法。如果采用基于 图像分割的自动图像分析,那就能在研究中使用不同类型的标记物,以便更加清晰地呈现细胞隔 室和组织。还可以考虑具有广泛染色模式的生物标志物,以便在整个研究期间评估组织质量。此外,还需考虑能够更加清晰地识别细胞亚型(例如免疫细胞类型)的生物标志物,以增加研究的深度。
抗体来源
对于各种多重成像技术,抗体可能最容易直接从仪器制造商处购买成套或试剂盒。也可能从设备 制造商处单独购买抗体,并根据所选系统定制它们。对于Cell DIVE,用户从他们选择的抗体公司 购买抗体。
成像系统的制造商还可能提供一份预先验证的抗体清单,例如Cell DIVE的验证抗体列表。为了节省时间和验证成本,应优先从这样的列表中选择抗体。在使用染料偶联抗体的系统中,选择商业 偶联、验证过的抗体,可能可以节省更多劳动力。
如果选择的抗体不在验证列表中,建议仔细查阅该列表,确保没有可用的密切相关抗体。例如,如果列表中提供了与首选抗体相同生物途径中的生物标志物的抗体,而首选抗体不在列表中,那么选择列表中的抗体可能是有利的。
在兼容抗体不在验证列表中的情况下,用户可能需要自己验证抗体(见下文)。在这种情况下,应该采购一小组(3-5个)候选抗体。这些候选抗体最好有一些文献支持,表明在感兴趣样本类型的IHC中有效。可以使用诸如citeab.com等抗体数据库来加速这一过程。如果抗体将被染料偶联,采购不含添加剂(如防腐剂)的抗体将加快整体工作流程。
抗体验证
在获得合适的抗体后,如有必要,应将其纯化,并与染料偶联或按所使用的多重成像方法适当制备,并在使用前进行严格验证,以确保生物标志物染色的特异性和敏感性。例如,Cell DIVE的抗体验证采用三步特征化过程。首先,应对候选抗体组进行基本的一次-二次染色,以评估基本的染色质量。其次,成功的候选抗体在多个染料-蛋白比(D:P)下偶联,然后以不同浓度暴露于组织。选择最成功的条件。第三,由于Cell DIVE使用循环染色和染料灭活过程,因此测试目标抗原对该过程的多次重复的耐受性。在每一步中,都将染色与文献参考和内部染色数据进行比较,以确保染色质量。
一旦进行了适当的验证,用户可以确信所选的抗体克隆和染色条件对他们的成像系统是满意的。 但是,当抗体供应商更换或获得新的主抗体批次时,应偶尔测试染色质量。
染色的注意事项
抗体染色的实际方法通常很简单,只需将抗体添加到组织中,在室温下孵育,然后洗涤并继续实 验。然而,在确定如何最终用制备好的抗体对组织进行染色时,有几个方面需要考虑。
染色顺序
在多重成像研究中处理10、20或100个生物标志物时,智能地确定抗体如何以及何时被染色和成 像至关重要。应优先考虑直接针对研究假设的关键实验生物标志物。之后,应优先考虑分割标记物,以确保分析流程能够顺利运行。在迭代方法中受到抗原效应影响的生物标志物也应在适当的 轮次中进行染色和成像。一旦确定了顺序,就应该按照计划对所有实验组的样本进行,以确保可 以直接比较荧光的定量读数。
选择通道
在选择给定生物标志物的适当染料和荧光通道时应谨慎。虽然有一些固定规则,但要记住,组织的自发荧光通常因用于成像的通道而异。组织的自发荧光通常在绿色通道(FITC、Cy2等)中最 亮,因此,只有最亮的生物标志物才应使用在此范围内可见的染料。相反,组织在远红(Cy5)或 近红外(Cy7)通道中的自发荧光通常最弱,因此可以考虑在这些通道中使用信号较弱的生物标志物和抗体。在验证过程中考虑您的抗体的性能,并据此规划基于轮次的复用方法。
浸出
一些抗体-抗原对会随时间失去亲和力。这可以表现为染料结合的抗体浸出到封片剂中,通过增加背景来降低图像质量。在抗体验证过程中可以评估浸出行为。如果识别出浸出,可以采取两种补救方法。首先,容易浸出的抗体应在自发荧光较低的通道中成像,因为随着浸出的发生,信号可能会随时间丢失。其次,通过优化整体成像工作流程,最小化染色和成像之间的时间。
一级二级对
一些多重技术,如Cell DIVE,允许在一项研究中使用少量的一级-二级对。这些应优先用于第一 轮,并计划在仔细观察跨物种兼容性的基础上进行。在结合二级抗体后,通常需要封闭组织以防 止二级抗体与后续轮次中的进入抗体发生交叉反应。虽然对于偏爱染料偶联一级抗体的技术来说并不理想,但一级-二级对可以是一种有用的方法,用于包含具有偶联问题的抗体并扩展整体面板。
拥挤剂
拥挤剂,如聚合物葡聚糖,可以添加到染色溶液中,以改善低丰度抗原的抗体结合,这些抗原可能难以检测。这些试剂可以增加局部抗体浓度,促进抗原-抗体反应。应谨慎测试染色混合物中选定拥挤剂的总浓度,以确保抗体的正常行为。此外,包含拥挤剂的染色混合物中的所有抗体都应经过仔细测试,以确保抗体活性不会受到不利影响。