介绍
宽场显微镜的特点是照明整个标本,与 共聚焦显微镜 不同,后者仅照明一个小点。其成员,特别是宽场荧光显微镜,是生命科学中应用最广泛的技术之一。例如,通过检测固定或活体标本中的各种 荧光标记 ,可以深入了解许多生物过程,如人类免疫系统。
人体在微生物入侵时表现出先天免疫和适应性免疫反应。随着时间的推移,适应性反应会发展出高度特异性的反应,而先天性反应则立即对病原体上特有的结构作出反应。这些过程被称为病原体相关分子模式(PAMPs),革兰氏阴性细菌细胞壁的特异性物质——脂多糖(LPS)是该模式的一个典型例子。LPS 与人类细胞表面的一种特殊受体结合——Toll样受体4(TLR4)。一旦结合,它可以触发一个细胞内过程,最终产生被称为细胞因子的促炎蛋白(图 1)。
在这个细胞内过程中的一步是NF-κB蛋白 从细胞质易位到细胞核。作为转录因子,NF-κB 支持相关细胞因子基因的转录。随后产生的细胞因子促使白血球(白细胞)释放活性氧(ROS)和活性氮(RNS),这些物质可以杀死细菌和病毒。不幸的是,ROS/RNS 也会造成附带损伤,并对细胞本身产生负面影响。受到 ROS/RNS 损伤的组织细胞释放所谓的损伤相关分子模式(DAMPs),这些分子本身可以触发 TLRs,重新启动整个过程,导致慢性炎症。这种自扩增Toll样受体自由基循环(TLR 自由基循环)与多种疾病相关,如帕金森病、中风、抑郁症、(自身)免疫性疾病或慢性阻塞性肺病(COPD),仅举几例 [1,2]。
除了上述由 DAMPs 引起的内在激活外,还有其他过程产生的物质可能启动该循环。例如,促炎细胞因子如肿瘤坏死因子α(TNFα)、由进一步细胞过程产生的活性氧(ROS)如 H2O2,以及诱导自由基的辐射。
利用倒置科研级显微镜可以支持对炎症分子过程的解读。本文描述了宽场显微镜对我们团队的重要性。最初我们考虑购买共聚焦激光扫描显微镜,然而,由于实际原因,最终选择了与 去卷积 相结合的宽场荧光显微镜,例如对于仅在有限时间内加入团队的学生,所需的培训时间较短。此外,宽场荧光显微镜具有非常好的活细胞成像能力,并且使用相对较低的光强度,从而减少了细胞应激。
一台配备各种荧光滤光片、专用物镜、快速滤光片转轮、环境控制和便捷成像软件的宽场显微镜可以揭示 TLR 自由基循环的许多方面。从普通的明场显微镜到免疫荧光实验,以及活细胞和 FURA 成像,我们可以研究许多重要现象,例如动物中受影响组织的命运、TLR4 与 LPS 的触发以及 NF-κB 随后的易位到细胞核,以及炎症时的 Ca2+反应。
材料与方法
细胞培养。 在 NF-κB 的免疫荧光成像中,使用了稳定转染人 TLR4、MD-2 和 CD14 的 HeLa 细胞。根据制造商的说明,细胞在补充 10% FCS(胎牛血清)和抗生素的 DMEM(Dulbecco改良Eagle培养基)中培养。对于显微镜实验,细胞被接种在玻璃盖玻片上,并在达到 60-80%汇合度时用于实验。
成像。 所有图像均在 Leica DMi8 倒置显微镜上拍摄,使用 Leica Application Suite X (LAS X) 软件,配备 Leica DMC2900 彩色相机用于组织学样本,以及 Hamamatsu Flash4 Cl sCMOS 相机用于荧光成像。为了进行活细胞实验,显微镜主体上附加了一个培养室,提供 5% CO2和 37°C。盲去卷积使用内置在LAS X 成像软件中的 AutoQuant 算法执行。
NF-κB 的免疫荧光动力学。 对于 NF-κB 易位实验,将种植在盖玻片上的细胞用 50 ng/mL LPS 刺激 60 分钟。刺激后,使用 4%甲醛在 PBS(1×;磷酸盐缓冲盐水;含钙和镁;pH 7.0–7.2)中固定细胞。随后,使用一抗和 Alexa Fluor568 标记的二抗对固定细胞进行 RelA(也称为 p65)染色——NF-κB 的一个亚单位。为了识别细胞核区域,细胞用 DAPI 进行复染。为了可视化细胞骨架,使用 Alexa Fluor 488 Phalloidin 对肌动蛋白纤维进行染色。样本包埋在 ProLong Gold 抗荧光淬灭剂中,并使用 Leica HC PL APO CS2 63×/1.40 油镜成像。
GFP-RelA瞬时转染HeLa细胞。 为了观察体内NF-κB的易位,用GFP-RelA质粒电穿孔瞬时转染HeLa细胞。。GFP-RelA 是 Warner Greene 赠予的(Addgene 质粒#23255) [3].。电转染后,细胞悬液被转移到含有细胞培养基的玻璃底小皿中。转染后 24 小时,使用 Leica HC PL APO CS2 63×/1.40 油镜和相机(2 × 2 binning像素合并)在显微镜下进行细胞成像。用TNF-α(10 ng/mL)刺激细胞后每五分钟拍摄一张图像。
FURA 成像。 钙测量使用了 FURA-2AM(Sigma-Aldrich)。这种 FURA-2 衍生物(乙酰氧基甲基)是可透过膜的,能够进行比率实验。HeLa 细胞与 FURA-2AM(1 μM)孵育 30 分钟。根据其结合钙状态,FURA-2 有两个激发峰值。钙结合的 FURA-2 在 340 nm 激发,自由 FURA-2 在 380 nm 激发。在这两种情况下,发射峰值均为 510 nm。对于比率实验,荧光发射强度在 340 nm 和 387 nm 激发后测量,使用快速滤光片转轮进行。为了在 340 nm 下实现最佳照明,使用了 Leica HC PL FLUOTAR(340)20×/0.80 OIL 物镜,其优化的透射率可达到 340 nm。液体应用使用了定制的微分配器。图像采集和比率测量使用LAS X 软件进行。FURA 成像和活细胞成像实验是在定制的塑料样品架的帮助下进行的,该样品架是为方便样品更换而制作的。 在圆形盖玻片上生长的细胞可以夹在标本架的两个半部分之间,并用液体覆盖(图 2)。
组织学。 4 周龄的 C57BL/6 小鼠在饮用水中接受 1.5%的 DSS(右旋糖酐钠硫酸盐)处理 10 天。随后,动物被处死,收集部分结肠进行组织学分析。结肠样本按照常规实验室方法处理并用组织包埋中心的Leica EG1150包埋在石蜡中。石蜡块使用 Leica RM2255 切片机和 Leica HI1210 水浴切成 4 微米薄片。之后,切片被放置在显微镜载玻片上,并使用标准方案用苏木精-伊红(HE)染色。
HE切片在显微镜下使用 Leica HC PL Fluotar 20×/0.80 油镜进行观察。根据样本大小,对照组每个切片扫描了 10 个视野,而 DSS 处理的小鼠每个切片扫描了 21 个视野,并使用LAS X 软件拼接。图 7 显示了这两种情况下 2 × 2 图像的局部。所有动物实验均在美因茨大学转化免疫学研究所的 Schuppan 教授实验室进行。小鼠的饲养、处理和安乐死均符合德国和欧盟的相关规定,包括实施欧洲理事会指令 2010/63/EU 的德国动物保护法。
结果
在 LPS 刺激下 NF-κB 易位到细胞核。 炎症是由信号级联反应引发的过程,始于模式识别受体(PRRs)的激活(图 1)。Toll样受体 4(TLR4)是这些 PRRs 之一。在 LPS 结合后,TLR4 复合体诱导细胞内信号网络,最终激活转录因子 NF-κB。转录因子随后从细胞质易位到细胞核,并促进促炎细胞因子的表达 [4]。
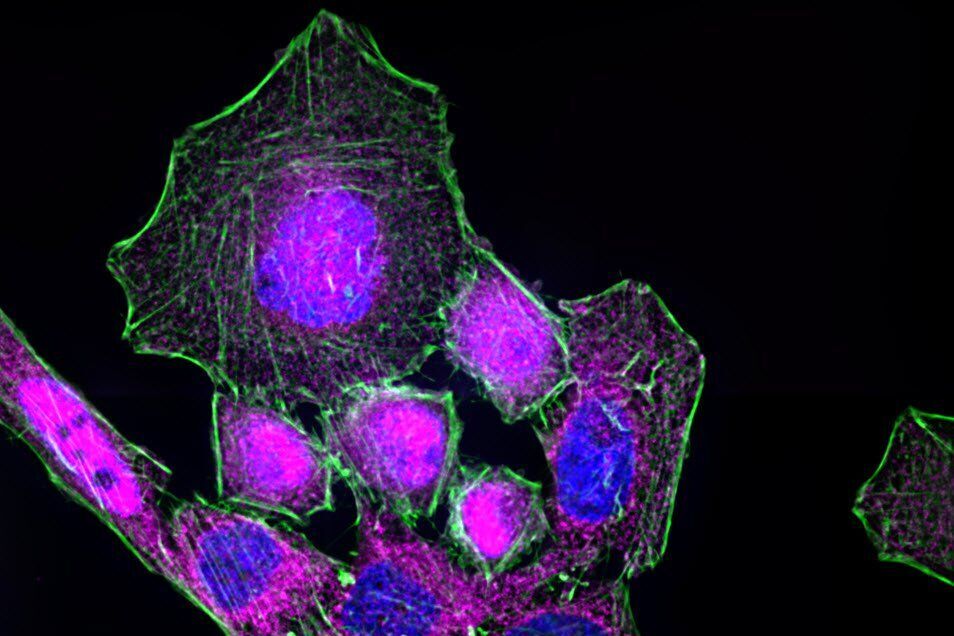
NF-κB 易位到细胞核的过程可以通过荧光显微镜进行研究。为此,稳定转染了 TLR4 构建体的 HeLa 细胞被暴露于 LPS 中 60 分钟。固定后,对 NF-κB 的亚单位 RelA 进行了免疫染色。作为对照,未刺激的细胞也进行了标记。
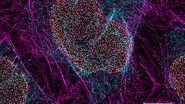
在未刺激的细胞中,NF-κB(品红色)主要位于细胞质中(图 3)。经过 60 分钟的 LPS 刺激后,NF-κB 易位到细胞核中。通过绘制一个细胞中 NF-κB 的荧光强度曲线,确认在未刺激的细胞中,NF-κB在细胞核周围有最高的表达量。然而,在细胞核内可以检测到低水平的 NF-κB 信号,这可能是由于来自细胞核上下层面的 NF-κB 分子的非焦信号造成的。使用共聚焦显微镜获取薄的光学切片可能会减少这种情况的发生。
反卷积是另一种选择,可以避免因非焦信号而产生的误解。宽场显微镜不仅检测焦平面中的光,还会检测到来自其他平面的散射光。反卷积软件算法可以帮助将荧光信号重定向到其来源。图 4 展示了这种方法。用荧光显微镜成像的免疫染色 HeLa 细胞经过反卷积处理,该过程集成在成像软件中。与原始图像相比,反卷积图像显示出更清晰的细节,同时仍保持定量数据。因此,可以更精确地确定 NF-κB 分子的位置信息。
可以想象,这些基于荧光显微镜的图像可以用作易位测定,通过在孵育后不同时间点固定细胞并测量 NF-κB 在细胞核和细胞质之间的比率。在这样的测定中,可以测试抗炎成分。例如,可以将潜在物质添加到细胞培养中,并直接观察其对 NF-κB 易位的影响。与其他基于筛选的方法相比,这将提供单细胞水平的信息。
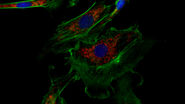
通过用带有荧光标记蛋白转染细胞,可以通过活细胞成像检测感兴趣蛋白的动力学。为此,HeLa 细胞被转染了 NF-κB 亚单位 RelA-GFP。除了 LPS,还有其他刺激物会引发 NF-κB 易位到细胞核。其中之一是 TNFα。因此,转染的 HeLa 细胞在活细胞成像之前接受了 TNFα处理(图 5)。
可以看见,NF-κB 在细胞核中的浓度在 TNFα刺激后显著增加。经过 20 分钟,大部分转录因子已易位。值得注意的是,在达到这一峰值后,NF-κB 开始重新定位到细胞质中。
上述荧光显微镜实验已建立使用 NF-κB 作为炎症指示剂。它们可以用于测试细胞培养系统中的促炎和特别是抗炎物质。这可能揭示慢性炎症的潜在治疗方法。
炎症期间的电信号传递。 炎症反应与细胞内和细胞间的电信号传递有关。离子通道在炎症中高度参与,其表达和功能可以受到 LPS [5,6] 或细胞因子和趋化因子的影响 [7] 。因此,除了上述提到的 NF-κB 易位实验外,测量离子信号可以深入了解促炎和抗炎刺激的效力。通过量化钙、钠和钾离子的细胞内浓度变化,可以研究刺激炎症的物质以及如何中断这一过程。
细胞内钙浓度可以通过荧光 Ca2+ 指示剂间接成像。一般来说,离子敏感的荧光染料可逆地与特定离子结合,并在结合时改变其荧光特性。其中之一是 FURA-2,它属于“双激发离子指示剂”。
根据其结合状态,它会改变其激发最大值。在未结合的 Ca2+ 的形式时在 380 nm 处被激发,而结合了 Ca2+ 的形式在 340 nm 处被激发。通过测量 510 nm 处的荧光强度比,可以得出 Ca2+ 的反应。使用比率法可以避免结果与 FURA-2 浓度或细胞厚度的局部差异相关带来的不精确性 [8]。
为了在我们的实验室建立比率成像的方法,制定了一套流程以及一个特殊的硬件设置,包括一个定制的微分配器,专门用于 HeLa 细胞。首次测量细胞电响应是通过使用 ATP 刺激这一易于获取的例子,而不是炎症。在这里,ATP 被用来引发由普遍表达的 P2Y 受体在细胞表面完成的典型生理反应。这个嘌呤能受体触发钙从内质网(ER)流出到细胞质中,然后可以通过 FURA-2 检测到。图 6 显示了上述比率实验。
在添加 ATP 后,钙结合的 FURA-2(激发波长 340 nm)的荧光强度增加,而同时无钙结合的 FURA-2(激发波长 387 nm)的荧光强度减少。刺激后约 100 秒,钙被转运回内质网,FURA-2 的荧光活性恢复到原始状态。
通过比率成像的选项,可以研究钙电位在炎症中的作用,并相应地将其用作炎症的指示器。例如,可以使用这样的模型来检查局部麻醉剂的抗炎能力。
在荧光显微镜下观察活细胞需要特殊组件以维持它们的活性并接近自然条件。例如,使用一个培养箱可以控制适当的环境温度。为了能够连续研究在盖玻片上生长的多个样本,使用了定制的样本架(见图 2)。借助这个结构,可以对活细胞进行成像。为了进行活细胞成像或 FURA 成像,盖玻片可以很容易地更换。
小鼠溃疡性结肠炎的研究。 溃疡性结肠炎是一种慢性结肠炎症。患者会遭受不断的腹泻,伴有血液。慢性失血可能导致贫血,这些个体面临更高的结直肠癌风险。
由于溃疡性结肠炎是一种慢性炎症性疾病,可以推测它与 TLR 自由基循环有关 [9,10] 。为了更深入地研究,实验室使用了小鼠模型进行检查。有趣的是,肠道疾病可以通过将 DSS 混入动物的饮用水中来诱发 [11]。接受这种饮食的小鼠表现出典型的溃疡性结肠炎症状。从它们的肠道制作的组织切片可以在明场照明下用显微镜成像。苏木精-伊红(H&E)染色将细胞核染成蓝色,细胞质染成红色,可以用于形态学检查小鼠结肠(图 7)。
与对照组相比,DSS 处理的小鼠在粘膜中显示出明显的病变,并且整体上皮结构发生了变化。此外,这些小鼠失去了粘膜的特征性内陷,即所谓的隐窝;通常它们的粘膜和黏膜下层被炎症细胞浸润。除了之前描述的细胞培养系统外,这种小鼠模型揭示了关于有机体水平的慢性炎症的结果。
讨论
许多疾病,包括神经炎症性疾病,如帕金森病或中风,以及系统性疾病,例如(自身)免疫性疾病或癌症,都与慢性炎症相关。理解慢性炎症的分子过程将为应对相关疾病和制定治疗策略打开新的大门。
除了分子生物学,宽场显微镜是获取 TLR 自由基循环(慢性炎症的基础)洞察的主要工具之一。例如,应用相对简单的免疫荧光显微镜在常规分辨率下,可以揭示 NF-κB 在 LPS 刺激下从细胞质易位到细胞核的过程。作为转录因子,NF-κB 增强促炎细胞因子的表达,推动 TLR 自由基循环。
有趣的是,不仅 LPS 能够通过 TLR4 信号激活启动炎症过程;还有其他来源可以间接触发 TLR4 信号。这些可以是例如纳米颗粒、过渡金属、半挥发性有机化合物或臭氧,它们会产生自由基或直接引发 DAMPs 的产生。如前所述,DAMPs 反过来可以激活 TLR4 通路。自然,进一步研究这一过程并解读其背后的机制是很有意义的。
除了探索这个恶性循环的基本过程外,可能还有方法可以打破它。我们现在有一个细胞培养模型用于观察 NF-κB 易位——作为炎症的指示——可以研究如何阻止这一进程。我们小组目前正在研究许多来自草本提取物的物质,以评估它们干扰转录因子易位进入细胞核的潜力。
除了在常规分辨率下的宽场荧光技术,使用超分辨率显微镜的方法 [12,13] 可能会提供关于炎症机制的更多细节,甚至在单分子分辨率下。
除了蛋白质状态,细胞的离子组成可以提供有关炎症过程的信息。通常,离子通道会对炎症作出反应,因为它们的表达和功能会受到细胞因子的影响。此外,Ca2+ 例如参与通过炎症小体的白介素成熟 [14] 。因此,它可以作为炎症进展的指示器。比率 FURA 成像在 Ca2+测量方面是一种强大的工具 [8] 。建立一个可靠的工作系统是进一步努力解读 TLR 自由基循环及其如何被破坏的基础。未来可以想象到能够筛选出对慢性炎症有影响的物质,这些物质可以通过改变 Ca2+反应来指示。
在这一点上,需要提到的是比率成像需要快速变化的激发波长或检测波长、强光源、优良的光学元件传输以及快速信号检测。超快滤光片转轮、UV光优化的物镜、高灵敏度荧光染料以及快速且灵敏的相机(sCMOS)的发展使得高空间分辨率的定量高速活细胞成像成为可能。
除了体外研究,炎症过程也可以在整个生物体中进行研究。因此,患有慢性结肠炎(溃疡性结肠炎)的老鼠是有趣的研究对象。在这种情况下,它们的组织学状态可以作为相应组织炎症程度的指标。在这一阶段,可以在完整的生物体中研究慢性炎症,以及例如特殊饮食如何影响溃疡性结肠炎,无论是负面还是正面。未来,将使用因氧化状态而改变荧光的染料作为活性氧(ROS)指标,以获得进一步的见解。
结论
许多不同的光学显微镜技术可以用于检查在基础炎症反馈循环中多个位置的慢性炎症。对比方法从明场显微镜到荧光显微镜不等,并提供比率成像的选项。被检查的样本可以是单个细胞的大小或整个器官。可以观察固定细胞和组织切片,也可以观察活细胞。有趣的是,对于本报告中描述的方法,研究人员不需要多台显微镜来进行所有不同的技术。由于现代生命科学研究显微镜(如 Leica DMi8)的灵活性和可升级性,加上用户友好的成像软件,细胞过程可以从多个方向突出显示。凭借这些优势,光学显微镜在生命科学中保持其地位,并将继续解读细胞生物现象,帮助对抗慢性炎症等疾病。
致谢
德特勒夫·舒潘教授非常友好地为我们的动物实验提供了他的设施。我们非常感谢弗兰克·赫莱斯博士、托马斯·克利马赫博士以及马克斯·普朗克化学研究所的车间为我们制作自制样品架。我们对乌尔里希·波施尔教授和马克斯·普朗克协会的支持表示衷心感谢。
参考文献
- K Lucas and M Maes, Mol Neurobiol 48 (2013) 190–204.
- K Lucas et al., CNS Neurol Disord Drug Targets 14(7) (2015) 838–54.
- LF Chen et al., Science 293 (2001) 1653–57.
- L Verstrepen et al., Cell Mol Life Sci 65 (2008) 2964–78.
- JJ Herskovic et al., Lung 180(4) (2002) 215–20.
- K Kandasamy et al., PLoS ONE 8(5) (2013) e63465.
- IA Hobai et al., J Surg Res 193(2) (2015) 888–901.
- A Takahashi et al., Physiological Rev 79 (1999) 1089–1125.
- X He et al., Sci Rep 6 (2016) article 28370.
- Y Fan and B Liu, Exp Ther Med 9(4) (2015) 1455–59.
- S Kitajima et al., Exp Anim 49 (2000) 9–15.
- C Cremer and BR Masters, Eur Phys J H 38(3) (2013) 281–344.
- C Cremer and U Birk: Front Phys 4(11) (2016).
- R van der Burgh and M Boes, Trends Endocrin Met 26(5) (2015) 263–71.