简介
我们对生物系统如何工作的理解与成像系统的能力密切相关,成像系统使我们能够以高时间和空间分辨率解析其所有相互作用的成分。生物系统是一个由各种成分(原子、分子、细胞、组织等)组成的复杂的层级网络,其成分跨越多个尺寸尺度。另外,这些成分在四个维度上的相互作用则更加复杂。理解这种动态行为是探究细胞功能和疾病机制的基础。研究人员可以使用各种各样的分子工具来揭示这些相互作用。然而,这些技术大多难以获得结构信息,或很难捕捉到高动态事件。
不幸的是,在动态环境中获得纳米级别的结构信息是一个重大挑战。大部分成像方案将生物体简化为静态物体,从而就无法获得其对动态信息。迄今为止,研究者们已经开发了几种技术来获得纳米级动态信息。
活细胞光电关联显微技术(CLEM)
活细胞光CLEM技术是生物系统研究中最常用的技术。这种技术能够对细胞进行成像,并在所需的时间点(例如,基于荧光显微镜观察确定的时间点)对其进行化学或物理固定。这项技术使样品能够在几秒钟内进行“及时固定”,从而可能实现在超微结构水平上,对罕见的动态事件进行研究。然而,活细胞CLEM只能够观察较为缓慢的动态过程中的超微结构。这主要是由于,成像和固定之间的仍需几秒钟,因此筛选完整的细胞单层或组织切片的效果较差,因为选择的固定样品的时刻,仅能够在该特定时间点采集少量图像。
使用光刺激或电刺激的高压冷冻技术进行样品固定
尽管活细胞CLEM适用于研究不同样本的各种过程,但我们依旧提供了具有超高时间分辨率的一体化工作流程。该工作流程通过对样品先进行光遗传或电场刺激技术,然后再使用高压冷冻进行物理固定。在实验过程中,样品一旦被插入高压仓,就会启动光刺激或电刺激,并在几个毫秒后固定样品。
光刺激结合了遗传操作和光学技术,通过使用特定波长的光,进行一段时间光照,来精确控制细胞功能。为实现这一目标,必须用膜结合的视蛋白(受体)来转染细胞。最常用的视蛋白是光敏感通道蛋白-2(ChR2)。ChR2是一种光控阳离子通道,最大激发波长为蓝光(450-490nm)。在被激发时,所吸收的光子会诱导产生全反式视网膜蛋白的异构化,从而导致通道打开,使钠离子和其他阳离子流入细胞。在神经元中表达时,这种阳离子流入会导致细胞膜的去极化,打开内源性表达的电压门控钠离子通道,从而产生动作电位 [1]。自光遗传技术出现以来,已经有许多视网膜蛋白被开发出来,同时光遗传学工具箱也在不断扩大。光刺激模块使用特定波长的LED光源和能将光引导到高压仓的光纤组成。电刺激装置,使用带有电容器和光开关的特殊中间片,在高压仓中产生一个电场。
图1所示为光刺激或电刺激高压冷冻固定后的处理流程,其中包括冷冻替代和常温超薄切片。
每种技术都有其优点和缺点。正在研究的特殊科学应用,将决定在纳米尺度探究特定过程的最合适的途径。本应用笔记的目的并不是为了严格展示所有的科学应用,而是以实用的方式来描述整个工作流程。在随后的说明中,将更深入地从科学视角,讨论这些技术在不同研究领域的科学相关性。
总体工作流程
步骤1:准备样品
海马神经元(由瑞士苏黎世大学药理学和毒理学研究所的G.Bosshard和S.Tyagarajan提供)可以被分离并培养在以聚-D-赖氨酸涂层的蓝宝石盘上,随后用层粘连蛋白包覆或用星形胶质细胞接种。或者在实验之前,可以从脑组织切下下丘脑切片,切片的厚度可达200μm,将其储存在充氧的人工脑脊液中。使用光刺激模块时,应该用视网膜蛋白转染细胞,并选择相应的激发光源。在堆叠多片蓝宝石盘时,需要使用生理盐水填充蓝宝石盘之间的间隙。
步骤2:准备仪器
EM ICE高压冷冻仪需要提前冷却,大约需要15升的液氮,在20分钟内准备好对样品进行玻璃化冷冻处理。光刺激和电刺激技术都是基于延迟玻璃化冷冻技术,可根据实验需要进行编程。为保持最佳条件,工作台和高压仓都需要加热到37°C。
步骤3:设置光刺激和电刺激过程
无论是进行光刺激还是电刺激,所有参数都可以在特定选项卡进行设置。
- 暗相:实验或程序步骤开始时的样品处于黑暗状态。
- 周期:由光(电)脉冲和脉冲后的弛豫时间组成的时间单位。
- 脉冲:周期内的光脉冲或电脉冲。
- #周期:总周期数。
- 频率/持续时间:每个步骤的总频率/持续时间。
- 电刺激偏移:电刺激程序的终点相对于冷冻过程中的0°C点的时间。
电刺激中间板的电容为50μF,电压为10V。实际电压取决于样品的电阻、实验的总持续时间和电刺激的模式。电压的降低遵循电容器放电的指数“衰减曲线”,并会取决于电刺激是连续的还是脉冲模式。
步骤4:加载样品
4.1 光刺激加载样品
根据光刺激实验选择一个光源模块,将光源模块插入仪器光源插座(图3A)。光刺激选项卡自动显示在主屏幕上,可以按下检查按钮来测试插入的光源模块。如图3B所示,应插入一个由2个蓝宝石盘组成的透明堆叠。加载完成后,中间板就可以在半圆弹道上移动(图3C),并通过关闭红色的盖子开始光刺激过程(见图3C)。一将弹壳插入高压仓(±400 ms后),程序设置的光刺激过程就会开始,样品将会根据程序中的延迟时间进行玻璃化冷冻。冷冻后的样品将被储存在样品容器中。所有参数都被存储在日志文件中。为了研究生物学过程,需要在不同的时间间隔冷冻多个样本。
加载时间在30到120秒之间,具体取决于样品的类型。
4.2 电刺激加载样品
在电刺激模式下操作EM ICE,要将工作站的黑色顶盖更换为充电器(图4A)。充电器正确连接后,电刺激选项卡将自动出现在主屏幕上。要在该模式下工作,必须连接蓝光模块。在该设置中,中间板上的电容器被充电,一旦样品进入高压仓,光源开关会关闭电路,开始对样品进行电刺激。每次实验之前,需要在样品装载前先测试中间板的功能,然后装载样品,如图4B所示。非导电间隔环用于组装夹层结构。图4D-I逐步说明了这一过程。其中,非常重要的一点是,样品中不能有气泡,也不要使液体溢出中间板,否则可能会导致电刺激失败。不能使用额外的低温保护剂,因为它会降低样品的电阻,导致电压降低。装载完关上盖子后,将装有样品的弹壳插入高压仓,则启动电刺激过程。电刺激开始后,样品将在所需的时间内被冷冻。为了研究生物学过程,需要在不同的时间间隔冷冻多个样本。
样品加载时间约为60秒。
步骤5:样品的处理
处理样品的最佳选择是使用冷冻替代,这是一种高通量的混合程序。此外,冷冻替代能够保存超微结构(特别是膜结构),它还允许在室温下对样品进行处理。玻璃化的样品被转移到EM AFS2冷冻替代装置。只处理生长有细胞的蓝宝石盘。如果夹层的零件不容易拆卸,可以将中间板浸入冷丙酮(–90°C)中。建议采用以下步骤处理冷冻替代中的样品:
- –90°C,持续8小时;
- –90°C至–60°C,持续1小时;
- –60°C,持续7小时;
- –60°C至–30°C,持续1小时;
- –30°C,持续4小时;最后
- 在–30°C至20°C持续2小时
进行冷冻替代后,将样品在丙酮中洗涤2次,用1%乙酸铀丙酮溶液染色1小时,再将样品在丙酮中洗涤2次,然后在4°C开始进行环氧树脂渗透(环氧树脂-芳二酸酯,66%丙酮溶液)。在室温进行100%环氧树脂渗透,然后在60°C聚合28小时。用UC6超薄切片机,切割厚度约70nm的薄片,使用1 x 2mm的铜槽载网收集,并用柠檬酸铅进行后染色。这里所展示的样品是用电刺激装置冷冻的对照样品(未进行电刺激)。
步骤6:成像和分析
无论是光刺激还是电刺激技术,都能从同一标本的多个样品中捕捉特定事件的图像,因此必须要收集一个大数据集。使用自动化TEM(透射光电子显微镜)的最新技术,超薄切片样品现在可以在一整晚时间完成成像,并通过移动计算机自动获取一个样品的多幅图像。然后,可以对采集的所有图像进行对齐和缝合,合成一个具有高分辨率数据的图像。这里所展示的图像是使用120kV Thermo Fisher Talos TEM在一整晚实验获得的结果。Thermofisher MAPS软件用于大面积高分辨率图像的自动采集。
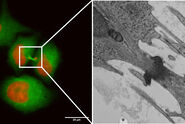
图5A和5B显示了对照样品(无电刺激)拼合的示意图。图5C展示了处理后样品的细节。在冷冻样品实验过程中,没有使用冷冻保护剂。结果显示,样品中微管和肌动蛋白丝都可以清楚地分辨出来,整个样品冷冻质量均匀。经过一夜采集,可以使用Thermofisher MAPS软件离线对整个数据集进行进一步的分析,并可以对感兴趣区域的图像进行对齐和拼合。图6所示的25幅海马突触图像是在筛选数据过程中,用大约10分钟时间选择的。