传统方法的局限性
足细胞是肾脏肾小球滤过屏障的关键细胞成分1。然而,它们是终末分化的,因此在正常条件下无法完成成功的细胞分裂。因此,足细胞耗竭(每个肾小球的总数或密度减少)是进展性肾病发展的重要指标。2事实上,足细胞耗竭已成为肾小球疾病的统一原则,目前通常通过在组织学切片中计数每个肾小球的足细胞核来评估3 。最近的研究突出了这种方法的局限性,包括准确性和精确性较低,以及生物变异性较高(特别是在小鼠研究中)。
立体定量方法,包括“基于模型”和“设计基于”(无偏)的方法,从采样切片中估算足细胞数量。基于模型的方法需要对足细胞核的大小和形状进行假设。通常,这些值是被假设的,假设与真实值的差异会导致估算值出现偏差。用于估算足细胞数量的设计基于立体定量的方法非常耗时,且仅被少数实验室采用。使用连续组织学切片的足细胞数量估算的替代方法4 (“详尽枚举”)也非常繁琐且劳动密集。
组织清晰和光学切片的结合使新的方法成为可能
幸运的是,新的组织透明化技术的出现5 ,加上通过共聚焦、多光子或光片显微镜实现的光学切片,使得全面计数不仅变得有吸引力,而且在足细胞数计以及任何其他感兴趣的细胞方面,尤其是那些在疾病的发展和进展中发挥核心作用的细胞,有了显著改善。
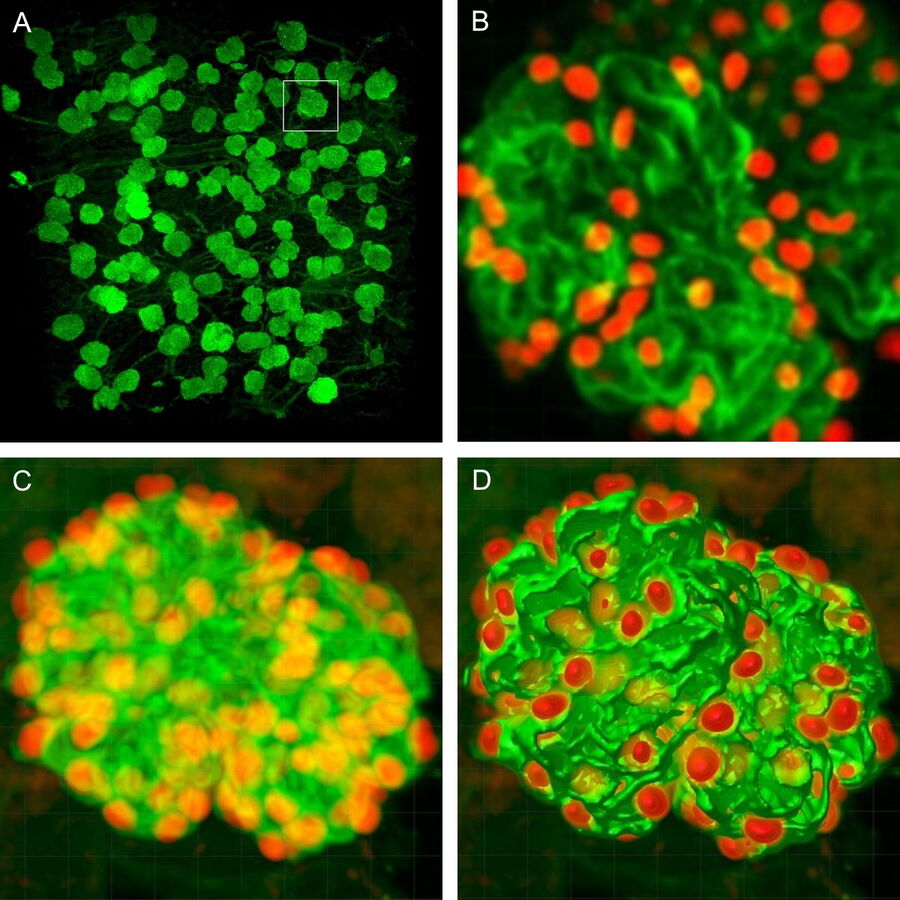
我们采用了这种方法,开发了一种新颖、高效的方法,通过免疫荧光、光学透明化、共聚焦显微镜和三维分析来研究足细胞耗竭6。该技术已用于量化在足细胞中持续表达人类白喉毒素(DT)受体的转基因小鼠的足细胞耗竭特征,这允许条件性和剂量依赖性的足细胞死亡。
我们的定量形态学工具改善了足细胞耗竭的评估,并允许对整个肾皮质中的肾小球进行研究。可以检测到单个肾脏中肾小球之间的足细胞耗竭差异,这是研究局灶性肾小球疾病的重要进展。
开发成像和量化足细胞耗竭的新方法
福尔马林固定的肾脏被切成 800µm 厚度的切片,然后使用改良的免疫荧光协议进行 1 小时的抗原修复。通过将切片嵌入琼脂糖中实现光学透明化,然后通过甲醇脱水,并通过多次更换苯甲醇和苯甲酸苄酯(BABB)进行透明化处理。
通过将脱水后的琼脂糖边缘粘贴到玻璃培养皿上,我们将厚肾脏切片固定在皿底,使其适合在配备专用 Leica 20x/0.95 NA BABB 浸没物镜的立式徕卡 TCS SP8 MP 共聚焦/多光子显微镜上成像。所使用的 BABB 混合物的折射率为 1.56,这也允许在需要时使用 x40 和 x63 油物镜在倒置显微镜上进行更高分辨率的成像。
为了计数足细胞,800µm 厚的肾脏切片通过分层成像获取肾脏的完整横截面。这有助于系统性地成像肾皮质,从表层到近髓区,以产生无偏结果。切片厚度可达 2mm(代表该物镜的全工作距离),也进行了成像,但一般来说,使用 800µm 的切片,在 1µm 间隔下跨 2-3 个通道成像,提供了理想的分辨率、工作深度和整体成像时间。
最终提供的数据集为分析提供了可量化的足细胞微结构,以及完整的三维肾小球可视化。使用所有细胞核的标记(DAPI)、足细胞细胞质(突触蛋白,SNP)和足细胞细胞核(p57),以及 Imaris(Bitplane AG,苏黎世,瑞士)中的掩膜和计数功能,可以确定每个分析的肾小球:(i)足细胞总数;(ii)平均足细胞体积;(iii)单个肾小球体积;并从这些数据计算(iv)足细胞密度(每单位肾小球体积的数量);(v)平均足细胞核体积;以及(vi)平均足细胞细胞质体积。
尽管图像分析组件并未完全自动化,需要人工监督,但计数和分析的效率明显优于迄今为止所有其他方法。一旦获得共聚焦图像,以上参数的值大约在每个肾小球 5 分钟内获得。
讨论与展望
样本准备技术的进步和成像创新不断推动生命科学发现的边界。通过灌注标记、荧光标记的特异性和光稳定性的改善以及组织透明化技术等创新标记方法,我们对组织微观结构和细胞及发育生物学的理解显著提高。
我们现在有能力在细胞和亚细胞水平上研究整个生物体、整个器官和组织。这些技术适用于荧光宽场、光片和共聚焦显微镜模式,所有这些都得到了广泛的高数值孔径、长工作距离物镜的支持,这些物镜与 BABB、Clarity 和甘油的折射率相匹配。
此外,图像分析可以有效地测量感兴趣特征的数量、长度、表面积和体积。然而,许多人面临的一个当前挑战是处理、分析和可视化这些随后变得更大的数据集,这些数据集的大小已经迅速从 GB 增长到 TB。为快速发展的生物图像信息学学科开发更好的解决方案变得越来越重要。
参考文献
- Reiser J, Sever S. Podocyte biology and pathogenesis of kidney disease. Annu Rev Med 2013; 64: 357-66.
- Fukuda A, Chowdhury MA, Venkatareddy MP, et al. Growth-dependent podocyte failure causes glomerulosclerosis. J Am Soc Nephrol 2012; 23(8): 1351-63.
- Puelles VG, Bertram JF. Counting glomeruli and podocytes: rationale and methodologies. Curr Opin Nephrol Hypertens. 2015 May; 24(3):224-30.
- Lemley KV, Bertram JF, Nicholas SB, White K. Estimation of glomerular podocyte number: a selection of valid methods. J Am Soc Nephrol 2013; 24(8): 1193-202.
- Silvestri L, Costantini I, Sacconi L, Pavone FS. Clearing of fixed tissue: a review from a microscopist’s perspective. Journal of biomedical optics. 2016; 21(8):081205.
- Puelles VG, van der Wolde JW, Schulze KE, Short KM, Wong MN, Bensley JG, Cullen-McEwen LA, Caruana G, Hokke SN, Li J, Firth SD. Validation of a Three-Dimensional Method for Counting and Sizing Podocytes in Whole Glomeruli. J Am Soc Nephrol 2016 Mar 14. (published ahead of print, doi:10.1681/ASN.2015121340)