简介
Coral Life 工作流程提供了一种简化的活细胞 CLEM 解决方案,用于深入了解细胞成分随时间发生的结构变化。
除了工作流程手册中描述的技术处理外,本文还提供了成功进行实验的其他知识。
在本例中,主要关注点是两个有丝分裂细胞的最终分离,即脱落。细胞分裂后,两个分裂细胞只通过细胞间桥相连,而这一间桥需要进一步研究。由于其体积庞大,活细胞成像无法完全了解这一机制。因此,需要通过超微结构分析来了解最终细胞分离的内在机制。
蓝宝石的制备
6 毫米蓝宝石盘需要在实际实验前进行清洁。清洗步骤如下:
- 在通风橱中将蓝宝石盘放入浓盐酸(HCl 30%)中浸泡 2 小时。
- 用双蒸(dd)H20 冲洗蓝宝石盘 3 次,每次 5 分钟。
- 之后将蓝宝石盘放在滤纸上晾干。
清洗过程结束后,需要在干净的蓝宝石盘上喷镀出网格图案。这一步至关重要!该图案可确保日后在树脂块中轻松检索样品位置和感兴趣的区域。在蓝宝石上绘制图案的步骤如下:
- 将一个干净的蓝宝石盘放入镀膜安装座的每个相应位置,并在上面添加一个 6 毫米的finder栅格掩模(图 1)。Finder 栅格掩膜外围有一个凹槽,用于指示掩膜的方向。所有掩膜应具有相同的方向,以便在后续步骤中始终显示蓝宝石的正确方向。建议将finder光栅掩模放在能产生可读字母的方位。
- 对于掩膜的喷镀,可以使用金或碳。在此,使用 EM ACE 600 碳线以脉冲模式(双线、100 毫米距离、210 瓦、150 毫秒脉冲长度)进行碳涂层。在蓝宝石上沉积了厚度为 10 纳米的碳层。
- 确保关闭旋转。这将使网格图案更加清晰。
- 根据镀膜仪和喷镀技术的不同,可能需要喷镀更厚的碳层才能获得良好的可见度。
- 如果使用碳,不要忘记将碳层稳定在 180 摄氏度以上过夜。
- 现在蓝宝石已准备就绪,可以按照工作流程手册(参考第 5.1 节)的说明设置 SampLink chamber。确保碳层朝向 SampLink chamber的内部。细胞需要在碳层顶部生长。
在将细胞种植到组装好的 SampLink 细胞室之前,需要再次对细胞室进行清洁和灭菌。在细胞培养罩中执行以下步骤:
- 在细胞室中注入 1 毫升 70% 乙醇并孵育 5 分钟。
- 用 dd H2O 冲洗 3 次。
- 让其干燥过夜。
- 紫外线灭菌至少 1 小时。
第二天:
- 用 PBS 冲洗 3 次。
- 加入 1 毫升 PBS 或培养基,将培养室放入培养箱中过夜。
- 培养结束后用 dd H2O 冲洗。
培养皿即可使用。将细胞直接种在蓝宝石上,或种在附加的聚合物或多肽涂层上。在这里,蓝宝石上的碳网格图案上涂有聚-L-赖氨酸(broid P1274,分子量 70,000-150,000 ,Sigma-Aldrich)。涂层用 0.1 mg/ml ddH2O 稀释。在每块蓝宝石上加入 50 μl 5 分钟,然后冲洗(3 次 ddH2O),并在通风橱中干燥 2 小时。
细胞孵育
这些实验使用了在 DMEM 培养基(10 % FCS ,1 % 青霉素/链霉素)中培养和孵育的 HeLa Kyoto HKF1、H2B-mCherry、alphaTubulin、mEGFP 细胞系。
- 每个 SampLink chamber培养 66,000 个细胞,在 37° C、5% CO2 条件下培养 24 小时。
- 在标准细胞培养箱中,将 6 个开放的 SampLinks 放入 140 毫米的培养皿中,然后盖上培养皿。在实际成像实验之前,需要将 SampLinks 完全组装好。按照 Coral Life 手册第 5.2.4 节的说明组装 SampLink 室。
- 如果直接在 OxyGenie 中培养 SampLinks,则需要在播种后直接组装 SampLinks chamber。注意:OxyGenie 需要 30 分钟左右加热。
- 在这些实验中,培养 24 小时后细胞的密度达到约 70%。
活细胞成像
一旦细胞达到所需的密度,6 个 SampLink chamber就可以安全地从细胞培养实验室转移到显微镜实验室。
若THUNDER显微镜与 SampLink chamber一起用于成像,以下是一些关于成像参数的提示和技巧:
- 设置平台的转移位置,以便之后轻松卸载 SampLink chamber进行冷冻(见工作流程手册第 4.1 节)。
- 生成定位概览:
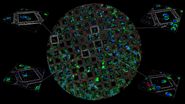
- 根据网格图案手动识别蓝宝石片中心(见图 2)。
- 确定后,从中心开始快速螺旋扫描,覆盖整个区域,以获得初步的快速概览。这样可以快速检查方向。此处直接使用 40x 水浸物镜。
- 为了进一步识别感兴趣的区域,还进行了带焦点图的螺旋扫描。这样做的好处是,如果蓝宝石片或chamber不完全平整,焦点就会得到修正。可以在多个通道中创建带聚焦图的序列扫描(图 3)。建议逐个通道运行,完成后再合并。
- 完成后,确定感兴趣区域 (ROI),如图 4 所示。每块蓝宝石片可以使用一个以上的 ROI 进行下游分析。但必须确保区域之间有足够的空间,以便修整或分割树脂块。
冷冻替代和包埋
本例中使用的是整体冷冻替代方案。这种技术可在样品内部进行强烈的金属染色,从而在扫描电镜成像时获得良好的对比度。它也可用于 TEM 成像;不过,由于脂质上的强金属堆积,分辨率会略有降低。在高倍放大镜下,样品会显得模糊不清。所使用的冷冻替代液含有 1% OsO4 + 0.2% 醋酸铀酰 + 2.5% H2O 的纯丙酮。
将样品在液氮下放入冷冻替代液中,然后转移到-90° C 的预冷 EM AFS2 系统中:
- 冷冻替代:
- -90°C,在冷冻替代液中放置 48 小时
- 每小时倾斜 5 摄氏度,直至 -30 摄氏度
- 保持 -30°C 4 小时
- 以 5° C/h 的速度递增,直至 20° C
- 保持 20 摄氏度 5 小时
- 对比:
- 在丙酮中清洗 3 x 10 分钟
- 在丙酮中加入 1%的硫代酰肼,在 室温条件下 20 分钟
- 在丙酮中清洗 3 x 10 分钟
- 2% 四氧化锇在丙酮中,RT 20 分钟
- 在丙酮中洗涤 3 x 10 分钟
- 2% 醋酸铀酰,丙酮,60° C,20 分钟
- 在丙酮中清洗 3 x 10 分钟
- 渗透:
- 30% Durcupan 在丙酮中浸泡 3 小时
- 70% Durcupan 在丙酮中浸泡 3 小时
- 100% Durcupan 3 小时
- 100% Durcupan 过夜
- 100% Durcupan 3 小时
- 60 °C 下聚合 48 小时
包埋完成后,将通流环 (16707161) 放入试剂槽 (16700154) 并注入一半的新鲜树脂。将蓝宝石转移到通流环中,用体视显微镜检查finder栅格的可读性(图 5)。然后,将通流环完全填满,并将样品放入 60°C 的烘箱中 48 小时。
取样和切片
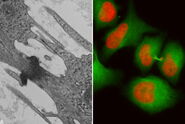
工作流程中最关键的步骤之一是取回树脂块中的 ROI,然后进行修块和成像。为了检查样品是否保存完好,建议在聚合后对树脂块的块面进行快速成像。在本实验中,将光学显微镜的数据与树脂块表面的图像进行了如下关联:
- 将样品从聚合的流动环中取出后,用手术刀从蓝宝石背面刮去残留的树脂薄层
- 用乙醇浸湿的纸巾清除残留碎屑
- 用金属夹具将样品块固定在THUNDER显微镜载物台上,使蓝宝石片(几乎)垂直于显微镜的光轴
- 通过树脂块的透射照明可用于成像
- 或者,也可利用树脂块在蓝光(470 纳米)下的自发荧光对细胞进行 "背照"
- 首先使用螺旋扫描对树脂块进行定位
- 然后绘制包含 5 个聚焦点的聚焦图和整个块面的图像扫描图
- 将扫描图像与概览图像合并,并导出为 tiff 和 jpg 文件
- jpg 文件可通过 Microsoft Office 的成像工具以正确的放大率叠加到活细胞图像上;使用 tiff 文件和 Fiji 软件可完成更复杂的叠加程序
注:在高压冷冻过程中,单个细胞或有时成批细胞从蓝宝石上脱落是正常现象。高密度或与基底结合不牢固的细胞(即有丝分裂细胞,因为它们会变圆,因此与基底的附着点会减少)会产生这种效果。使用较低的细胞密度和/或不同类型和浓度的涂层可以减少玻璃化过程中细胞的损失。
然后将蓝宝石从块面上剥离:
- 首先修剪掉蓝宝石周围过多的树脂。这可以用厚重的刀片来完成。
- 加热 EM MP 系统 (16705403),准备一个装有 LN2 的小杜瓦瓶。
- 用镊子夹住树脂块。
- 将树脂块正面朝下放在热的 EM MP 上 10-20 秒。
- 然后将树脂块直接浸入液氮中冷却。您会听到 "咔嚓 "一声。
- 用体视显微镜观察时,将锋利的刀片插入树脂和蓝宝石片之间。蓝宝石片应该很容易与树脂分离。否则,请重复加热/冷却步骤。
- 移除蓝宝石片后,您应该仍能观察到区块上的碳图案。
利用finder栅格的网格图案,您可以在区块上找到 ROI 并将其修剪下来。在这里,使用 EM TRIM2 对包埋块进行了修整。
在本例中,由于只有 5-7 个部分包含目标特征,因此必须进行序列切片。因此,切片被安装在slot grids上。由于使用了整体冷冻替代和渗透方案,因此无需进行后期染色。
数据后处理
本实验使用THUNDER技术对原始数据进行后处理。要了解有关THUNDER技术的更多信息,以及如何在 Coral Life 工作流程中使用THUNDER技术进行后处理和定位,请查阅应用说明:"如何使用 Coral Life 改进活细胞成像"。