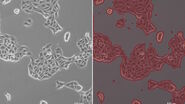
图1:利用相差技术和明场照明拍摄到的犬肾细胞(MDCK)图像。
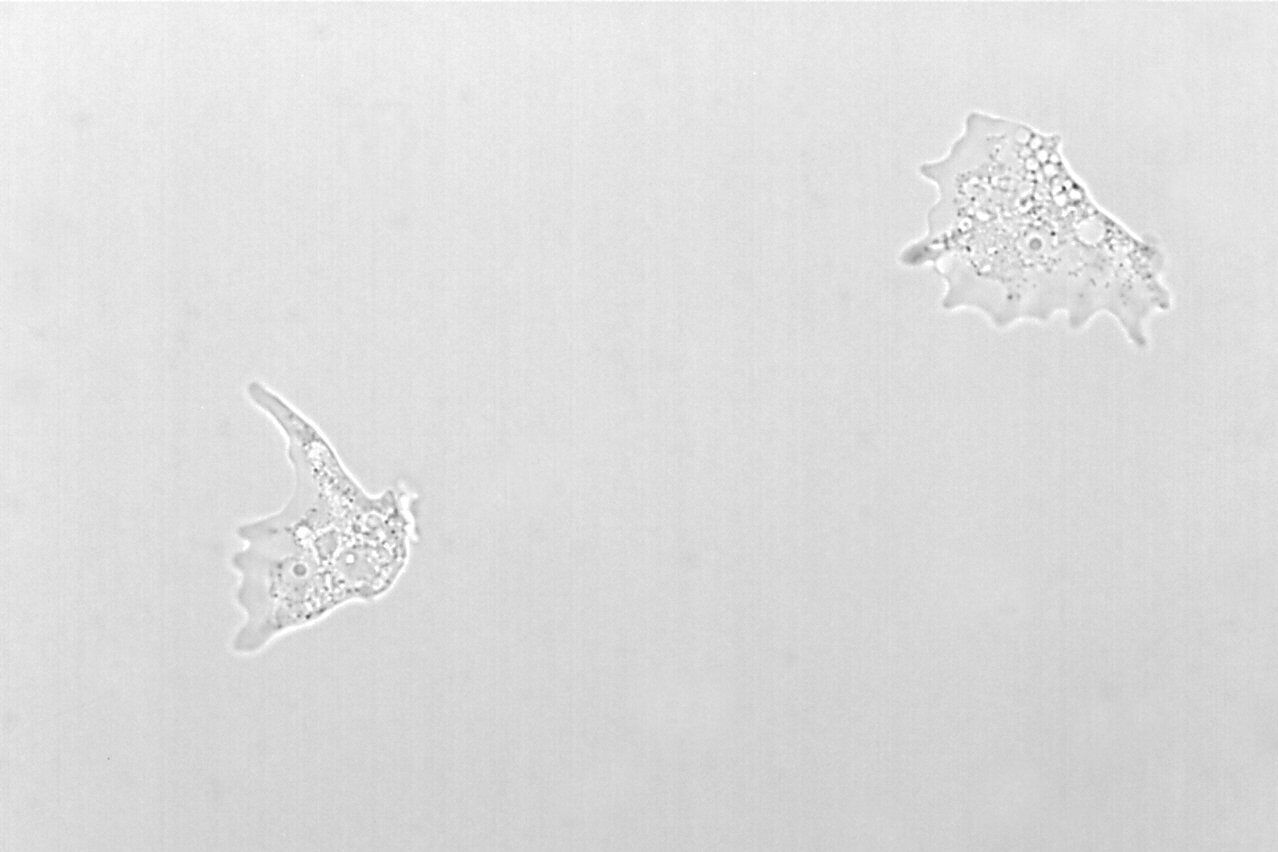
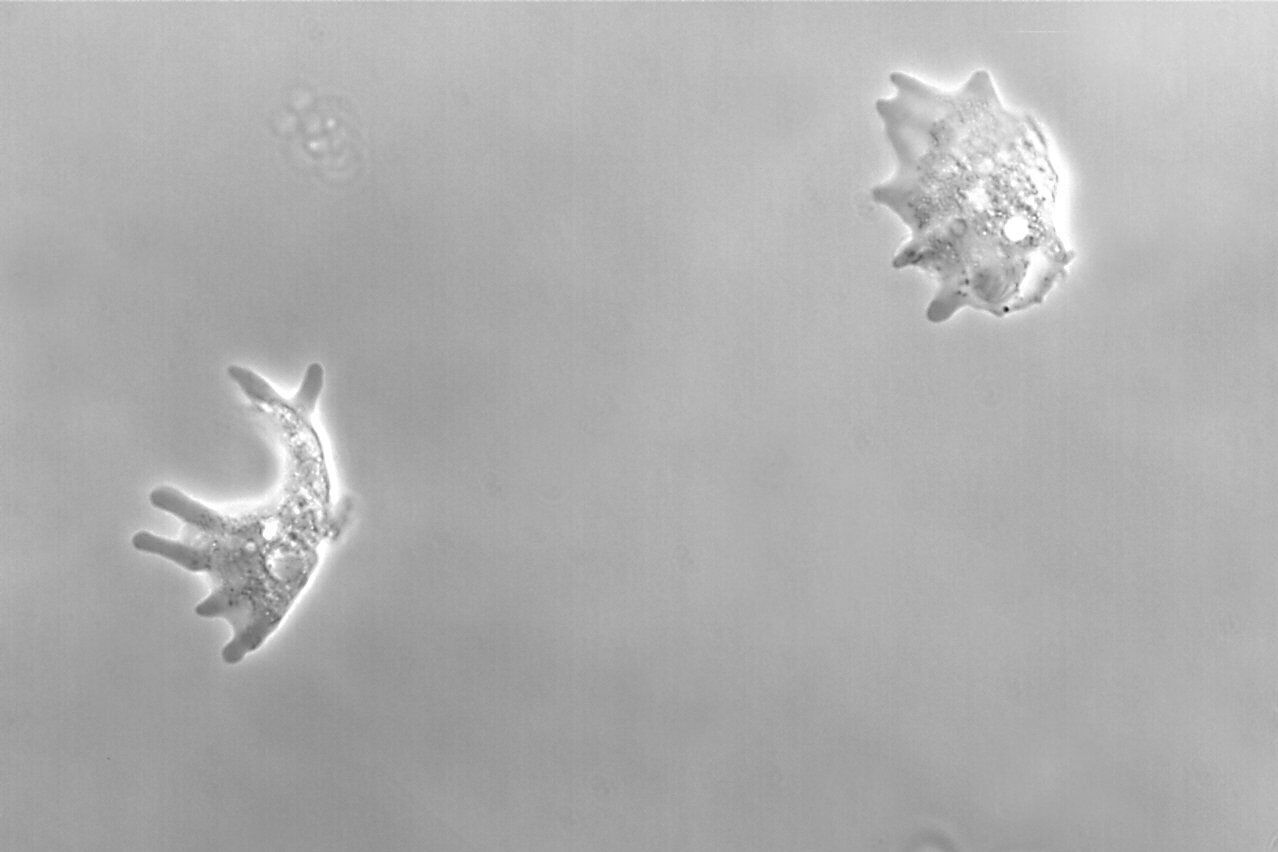
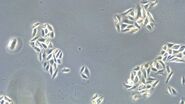
图2:利用相差技术和明场照明拍摄到的单细胞生物变形虫变形杆菌图像。
光波干涉
光路长度(OPL)是介质的折射率(n)与光线在介质中两点之间传播距离(d)的乘积。OPL = nd。光路可能需要光线穿过多种介质,例如气体、液体或固体。常见示例包括光线从空气进入水中,或者从空气进入玻璃。光路长度与光线的传输时间和速度有关。光路长度的差异导致光波穿过样本的速度不同,即相移。因此,相位存在差异。与周围介质相比,较高的折射率会导致光波减速并降低相位。
干涉描述了两道光波之间的相互作用,并按照叠加原则形成新的波形。光波干涉的相关参数是它们的振幅。如果两道波相互干涉,生成光波的振幅等于每个干涉光波振幅的矢量和。
如果形成光波的振幅增大,这种干涉可以描述为相长干涉(构造性)。只要两者的波峰和波谷在同一个时间点相遇,就会出现这种情况。也有可能,一道光波的波峰与另一道的波谷在同一个时间点相遇。这种情况会导致形成振幅较低的光波。这两道光波之间的干涉称为相消干涉(破坏性)。
相差显微镜中的光路
相差显微镜的关键元件是环形光圈和相位板。环形光圈位于聚光镜的前焦平面内,限制了光波穿透的角度。相位板位于物镜的后焦平面内,搭配相差环,其材料可以按照λ/4的幅度调暗穿过相位板的光线,其中λ代表光线的波长。
在采用科勒照明的相差显微镜[5]中,不与样本相互作用的光波在物镜的后焦平面上聚焦为明亮的光环。光环沿光轴方向上与相差环形成空间匹配,引发未偏离光的相移。样本衍射产生的光线并不完全照射在相差环上,因此不受影响。
受影响和未受影响的光波之间,最高可以形成λ/2的总相移。未偏斜光的相位在相差环处会提前λ/4,穿过生物样本时的衍射或散射光波通常会延后λ/4。λ/2的总相移会令光波在图像平面内产生相消干涉。为了增强对比度,未偏斜光在穿过相差环时会变暗并且有一部分光线会被相差环吸收。一定要避免未偏斜光比偏斜光更加明亮的情况,因为那会降低对比度。
相差显微镜中观察到的λ/2相移会产生最大程度的相消干涉效应,因为光波的波峰和波谷在同一时间点重合。因此,生成光波的振幅会减少,相位物体的相移转换为振幅偏移。
正相差和负相差——两种形式的相差
相差分为两种形式:正相差和负相差两者的主要区别在于使用的相位板。对于正相差,穿过相差环的光线相比偏斜光会增加,对于负相差,相位会减少。负相差中的相位延迟会产生相位差异,导致光波受到破坏。光波存在相位,并引发相长干涉,而非相消干涉,导致生成的光波振幅增加。
在正相差显微镜中,折射率高于周围介质的对象比折射率较低的对象显得更暗。在负相差显微镜中,情况完全相反。
解读相差图像
相差显微镜可以视觉呈现光线穿过样本时的光路长度差异。光路长度与样本的厚度和折射率有关。细胞膜和细胞器等细胞结构对于光路长度具有深远的影响。由于许多细胞(特别是细胞培养液中)具有扁平且规则的形状,因此使用明场显微镜几乎无法看到它们。
这种细胞相差图像可以放大细胞结构的差异,可以视为光致密图,因为光密度对于样本或样品的折射率有很大影响。不过,多种效应会导致相差图像的正确解释变得复杂,因为它们不直接取决于光路长度的差异。
光晕效应可以描述大型相位物体周边出现的正相差亮边或负相差暗边。光晕会形成是因为来自样本的部分衍射光会穿过相差环。未偏振波形成的光环要比相差环小一点,因此来自样本的低空衍射光波可以穿过相差环。穿过相差环的偏斜光保持着90°的相差,因此不受干涉的影响。这会导致对比度反转,导致大型物体的边缘出现光晕。
遮光效应是指样本的均匀部分和周围介质一样,以相同的光强度来显示所发生的情况虽然穿过这些区域的光线会发生相移,但只有轻微的衍射,且散射角度大幅降低。因此,这些光波进入相差环时,就像未偏斜光一样,不会发生干涉。
相差显微镜的另一个问题就是可能发生对比度反转。如果折射率很高的物体旁边是折射率较低的物体,它们就会显得更加明亮,而不是更暗(正相差的原因)。在这些区域,相移不是生物样本常见的λ/4,因此会出现相长干涉,而不是相消干涉(这与负相差正好相反)。
虽然这些效应会让相差图像在解读时更加困难,但相差显微镜是一种简单且重要的光学对比成像技术,可以对相位物体成像。此外,相差显微镜能够研究活体样本中的细胞功能和结构,因此是生物学研究中最为常用的光学对比法。