引言
秀丽隐杆线虫已被作为神经科学、发育生物学、分子生物学和遗传学的模式生物使用了40多年 [1]。它是第一个完整测序的多细胞生物 [2] ,直到现在,也是唯一一个完全绘制了其连接组(即神经系统中神经元连接的图谱)的生物 [3]。这种线虫是一种具有遗传确定的细胞数量的真核生物,在幼虫阶段结束时保持恒定,其神经系统包含302个神经元(神经细胞)。线虫被用作研究神经发育、细胞分化、凋亡(程序性细胞死亡)、衰老等领域的模式生物。C. elegans的大量基因在功能上与哺乳动物的基因类似。C. elegans基因组中约有1/3的基因与人类基因同源(来自共同祖先),因此使得线虫成为研究与人类相关疾病的模式生物。这些线虫在实验室中培养起来相当容易且快速,通常保持在室温以下(15-20°C)。成年线虫长度约为1毫米,直径小于75微米。它们被放置在琼脂平板上,即培养皿内的琼脂凝胶上,以大肠杆菌作为食物。
秀丽隐杆线虫(C. elegans)的常规工作步骤
在与线虫进行日常实验室工作时,有几个常见的步骤(如图1所示):
- 拾取线虫 [4];
- a) 转基因 [5, 6]:将转基因片段微注入线虫中,以修改其基因组;
b) RNA干扰(RNAi) [7]:将双链RNA导入线虫中,抑制基因表达; - 筛选:评估线虫以检测RNA干扰或转基因的成功;
- 使用各种方法研究线虫的分子生物学、生物化学和遗传学;
- 线虫的文档记录或功能成像,通常使用共聚焦或复合显微镜完成。
上述所示的工作步骤不一定按线性顺序进行,即非线性的“工作流程”。首先,必须选择并“拾取”线虫,然后进行基因或蛋白质表达的操作,接着培育线虫一段时间。然后通过表型(可观察特征)来区分线虫,以找到具有所需特征的线虫。如果这些线虫数量太少,则可能需要重复前面的步骤。当有足够数量的具有感兴趣特征的线虫时,再次进行“拾取”,使其固定,最后进行功能成像。
下面的照片(图2)展示了德国康斯坦茨大学分子微生物学系的典型线虫实验室。
优化工作效率的关键考虑因素
优化工作效率将取决于应用和使用方式,即是在实验室进行研究还是在教室进行教学。
线虫培养和成像的一般考虑因素
在培养、挑选、筛选线虫等过程中,有几个要考虑的要点
- 在更换琼脂平板时避免重新对焦 → 每个平板中使用相同量的琼脂(相同高度)
- 获得更清晰的线虫显微镜图像 → 平板上大肠杆菌(食物)的浓度较低
- 降低线虫成像平板的荧光背景(自发荧光)→ 使用薄的琼脂层,并去除胨 [4]
- 确保线虫与琼脂有明显对比度 → 通过透射光获得良好的对比度是重要的
- 检测更微弱的荧光信号以获得更好的图像结果 → 良好的荧光信噪比(S/N)和暗背景非常关键
- 在较高的总放大倍数(60倍以上)下成像线虫时确保良好的对比度和高分辨率
拾取线虫
研究实验室
在选择适合的线虫并为其进行遗传学或生物化学分析时,通常会使用体视显微镜选择线虫,并用小型铂丝或睫毛将其取出(图3)。然后,为了通过在线虫的生殖腺中进行微注射进行遗传修饰,将它们放置在玻璃载玻片上的小干燥琼脂垫上(图3)。
明场下的线虫筛选
利用来自徕卡显微系统公司的几种体视显微镜系统可以实现高效的线虫筛选,以提高工作效率。配备LED底座或小型翻转照明底座的体视显微镜 [8] (图5)非常适用于线虫筛选。由于紧凑的设计,这种显微镜在实验室中占用的空间也较小。使用这些显微镜可以轻松获得高对比度的线虫图像,即使在低放大倍率下也可以做到。它们是教学人员的理想选择。
下表列出了使用徕卡体视显微镜,在明场下进行线虫筛选时,使用LED灯底座或照明底座的不同优势。
以下是徕卡体视显微镜中LED灯座和小型翻转照明底座的优势比较: | |
|---|---|
| LED 灯座 | 照明底座 |
|
|
使用TL3000 Ergo照明底座(图6),也可以通过M80体视显微镜 [10]实现高效的线虫筛选。M80的光路为CMO(common main objective),因此不存在倾斜的焦平面,整个视野对于双眼都能保持清晰聚焦。此外,该系统是模块化的,可以快速灵活地添加、交换或更换组件。如果需要同时由多个用户观察标本图像,并记录高分辨率图像用于报告,还可以安装数字相机。例如,Leica数字显微镜相机 [12] 可生成高清的实时影像和图像记录。
转基因、微注射和RNA干扰
有几种方法可以改变线虫的基因/蛋白质表达。通过显微注射将基因引入线虫进行稳定和瞬时基因修饰。主要的两种方法是:转座子 [13],也称为跳跃基因,或CRISPR/Cas9 [14] 系统。使用CRISPR的转基因效率较低,需要一个世代周期进行筛选,但转基因的插入更加稳定。转座子方法效率高,需要注射的线虫较少,但不好确定转基因插入到基因组的具体位置。
将线虫放置在玻璃载玻片上的干燥琼脂平板上后,需要快速操作,否则线虫可能在过程中脱水死亡。为了减缓线虫的脱水,通常会涂上油,如卤碳或石蜡 [6]。通常,微注射应在5分钟内完成。将带有琼脂平板的载玻片放置在倒置显微镜的台上,定位线虫,然后将转基因(DNA)注射到远离生殖腺的位置。
然后,用恢复缓冲溶液 [6]覆盖线虫,用铂丝或睫毛夹取,并将其放置在单独的琼脂平板上进行进一步培养和繁殖。这个步骤通常在配备差示干涉对比(DIC) [15] 或集成调制对比(IMC)照明 [16]的手动倒置复合显微镜上进行,例如DMi8(图7)或DM IL LED [17]。强烈建议在显微镜下采用抗震设置以获得更高的产量。
为了精确定位微注射的针头,使用高精度的3轴油压操作器非常实用,例如来自Narishige Instruments的操作器。
RNA干扰(RNAi)用于在翻译水平上改变蛋白质表达。通过喂养表达双链(ds)RNA的转基因细菌给线虫进行。线虫摄食dsRNA,它进入所有线虫的细胞中(除神经元外),在细胞生物化学作用下进行处理,然后产生短干扰(si)RNA。一旦存在于细胞中,siRNA改变蛋白质表达。
转基因线虫繁育和荧光筛选
注射后,线虫将进一步培养,下一代将用于实验。线虫在20°C下进行繁殖。必须避免线虫脱水,因此琼脂平板通常存放在塑料盒中。为了获得非常多的线虫,还可以使用埃伦迈耶烧瓶中的液体培养。
大约需要五只线虫进行Western印迹分析(识别蛋白质)[18]。然而,进行差速离心以根据密度分离细胞器和蛋白质通常需要10万只线虫 [19]。
由于转基因通常与绿色荧光蛋白(GFP)[20] 结合,可以使用荧光体视显微镜进行筛选。其他荧光标记物如DsRed [20] 在高表达水平下可能具有毒性,因此通常选择GFP作为标记物。
线虫必须在明场和其他对比度(大视场)下进行定位,并检查是否存在荧光信号,然后选择进行进一步实验。对于成像,通常更喜欢使用年轻的线虫,因为老龄线虫通常在肠道中会有更高的自发荧光。选择的线虫被放置在特殊的小琼脂平板上,不含肽胨和细菌,以最小化自发荧光。琼脂层通常非常薄,以进一步减少自发荧光。
使用徕卡TL照明底座(图8),可以使用M165 FC [21] 或MZ10 F [22] 荧光体视显微镜进行高效的线虫荧光筛选。
优势
- 由于有许多照明对比度选择,线虫的单个细胞很容易区分。
- 可以快速切换对比度以进行高级文档记录和成像。
- 由于TripleBeam技术具有最高的信号与噪声比(S/N比),荧光信号强度高→激发和观察分开的光束路径。
可以查看秀丽隐杆线虫在琼脂平板上的视频,只需点击下面的视频。视频中仅检测到荧光发射的光,不使用其他照明(暗背景)。视频中大多数线虫在肠道中显示一些自发荧光[23]。只有一个线虫呈双阳性,并且在其咽部表达的荧光蛋白mCherry[20] 也显示出明亮的信号。该视频是使用Leica数字显微镜相机,通过M205 FA荧光体视显微镜录制的。视频播放速度略快于原始录制速度,因此线虫可能看起来比实际移动更快。
Important considerations for fluorescence screening
- To achieve the highest contrast and resolution, a transmitted light base with its sophisticated construction acts like a light condenser at high magnification.
- Little or no background light “noise” for fluorescence imaging is produced by the Leica TL bases.
- Avoid heating the worms when undesired using a Leica TL base with external light source.
- For the case of high autofluorescence, reducing fluorescence excitation intensity will increase the S/N ratio. In many cases, the fluorescence signal from the worms is maximal and cannot increase more, but the background always can.
- Depending on the budget and demands of individual users, the TL3000 or TL5000 Ergo [11], light bases can all be used.
功能成像
共聚焦显微镜和复合显微镜通常用于线虫的成像和文档记录,以获得亚细胞和大分子结构的高分辨率图像,例如STELLARIS共聚焦系统 [24] 和DM6或DM2500正置显微镜[25]。
对于共聚焦成像,线虫表达荧光蛋白,如绿色荧光蛋白(GFP),红色荧光蛋白(RFP,mCherry或DsRed),黄色荧光蛋白(YFP)或青色荧光蛋白(CFP) [20],如上所述(图9和10)。
基于正置的共聚焦显微镜更适合,因为线虫位于琼脂层的顶部。线虫移动相对较快,因此通常使用药物Levamisol对其进行麻醉,然后在其上方放置一个覆盖玻片以便通过液体浸润目标进行观察。
幼虫期的线虫对光非常敏感,因此使用共聚焦扫描共振扫描头,由于其较短的停留时间,可以将光毒性问题降到最低。其允许长时间观察秀丽隐杆线虫幼虫而无明显损伤。
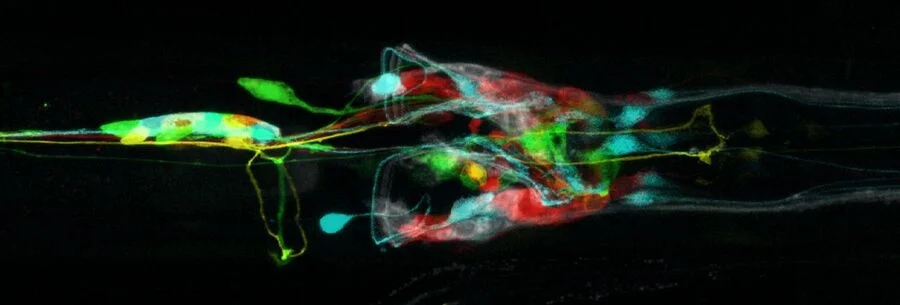
图10:秀丽隐杆线虫(从线虫腹侧观察)的脑部和神经系统的共聚焦显微镜图像(Leica SP2)。神经元细胞表达荧光蛋白CFP、GFP、YFP和DsRed,并用白色亲脂示踪染料DiD标记。图片由加拿大不列颠哥伦比亚省本拿比市西蒙菲莎大学生物科学系的H. Hutter提供 [26]。
总结与结论
秀丽隐杆线虫的常见方法 [27] 包括使用体视显微镜、复合显微镜或共聚焦显微镜进行多个工作步骤。线虫实验室的需求可以有所不同。可以使用多种配置和仪器来完成工作步骤中的特定任务。
以下是常用显微镜解决方案的列表:
- 用透射光底座产生高对比度的格林诺夫体视显微镜常用于挑选线虫;
- 用倒置式复合显微镜(如DMi8)进行转基因微注射,使用显微操作器将针头定位并使用注射器注入DNA。此外,集成调制对比(IMC)是首选的照明方法;
- 荧光筛选可以使用多种荧光体视显微镜实现,例如MZ10 F或M165 FC,使用透射光底座获得非常好的对比度;
- 明场筛选通常使用CMO体视显微镜(如M80),具有高对比度的透射光底座;
- 功能成像,例如转基因线虫的细胞分化、凋亡(程序性细胞死亡)、衰老、神经活动等研究,可使用直立式复合显微镜或共聚焦显微镜,如DM6或STELLARIS 8;
- 固定的线虫也可使用性能更高的荧光体视显微镜(如M205 FA)和透射光底座(如TL5000 Ergo [11] )以合理的分辨率进行成像;
- 对于线虫胚胎的成像,建议使用共聚焦共振扫描仪以降低光毒性;
- 对于课堂、实验室和培训,显微镜设置要求可能与研究实验室不同。
这份简短报告可以在建立线虫实验室时作为有用的参考或指南,并解释进行必要工作步骤所需的各种仪器。
参考文献
- Brenner S: Nature’s Gift to Science. Nobel Prize Lecture (December, 2002), The Nobel Foundation.
- The C. elegans Sequencing Consortium, Genome Sequence of the Nematode C. elegans: A Platform for Investigating Biology, Science 282 (1998).
- Emmons SW: The beginning of connectomics: a commentary on White et al. (1986) – The structure of the nervous system of the nematode Caenorhabditis elegans – Philosophical Transactions of the Royal Society B 370 (1666) (2015); doi: 10.1098/rstb.2014.0309.
- Stiernagle T: Maintenance of C. elegans. Wormbook: The Online Review of C. elegans Biology (2006).
- Schweinsberg PJ, and Grant BD: C. elegans gene transformation by microparticle bombardment. Wormbook: The Online Review of C. elegans Biology (2013).
- Evans TC: Transformation and microinjection. Wormbook: The Online Review of C. elegans Biology (2006).
- Ahringer J: Reverse genetics. Wormbook: The Online Review of C. elegans Biology (2006).
- Leica Stereo Microscopes, Leica Microsystems Website.
- Illumination for Leica Stereo Microscopes, Leica Microsystems Website.
- M50, M60, M80 – Brochure. Leica Microsystems Website.
- Leica Transmitted Light Bases. Leica Microsystems Website.
- Leica Digital Microscope Cameras, Leica Microsystems Website.
- Pray LA: Transposons: The jumping genes. Nature Education 1 (1): 204 (2008).
- Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, and Zhang F: Genome engineering using the CRISPR-Cas9 system. Nature Protocols 8: pp. 2281–308 (2013); doi: 10.1038/nprot.2013.143.
- Ockenga W: Differential Interference Contrast (DIC). Science Lab.
- Kleine B, and Veitinger T: Integrated Modulation Contrast (IMC): Oblique Illumination Enhances Visibility of Living Cells. Science Lab.
- Leica Inverted Compound Microscopes, Leica Microsystems Website.
- Mahmood T, and Yang P-C: Western Blot: Technique, Theory, and Trouble Shooting. N. Am. J. Med. Sci. 4 (9) 429–34 (2012); doi: 10.4103/1947-2714.100998.
- Mašek T, Valášek L, and Pospíšek M: Polysome analysis and RNA purification from sucrose gradients. Methods Mol. Biol. 703: 293–309 (2011); doi: 10.1007/978-1-59745-248-9_20.
- Greb C: Fluorescent Proteins – Introduction and Photo Spectral Characteristics. Science Lab.
- M165 FC, M205 FA – Brochure. Leica Microsystems Website.
- MZ10 F – Brochure. Leica Microsystems Website.
- Pincus Z, Mazer TC, and Slack FJ: Autofluorescence as a measure of senescence in C. elegans: look to red, not blue or green. Aging 8 (5): 889–98 (2016).
- Leica Confocal Systems, Leica Microsystems Website.
- Leica Upright Compound Microscopes, Leica Microsystems Website.
- Hutter H: Five-colour in vivo imaging of neurons in Caenorhabditis elegans. Journal of Microscopy 215 (2): 213–18 (2004); doi: 10.1111/j.0022-2720.2004.01367.x.
- Worm Book: The Online Review of C. elegans Biology.