引言
果蝇(Drosophila melanogaster)作为遗传学研究的模式生物,已超过100年,并且在遗传学、生理学、病理发生和进化等领域的发育生物学研究中仍被广泛使用 [1,2]。养殖大量果蝇相对容易且成本较低。它繁殖迅速,产卵量大,寿命仅为2周[1,2]。果蝇只有4对染色体 [3],其中许多染色体较大,便于定位突变 [4] 和缺失 [5]。它的整个基因组 [6] 已被测序,并且有许多可供使用的突变体。果蝇基因组和人类基因组中发现的与癌症和疾病相关的基因具有显著的同源性 [7,8]。
在进行常规果蝇(通常为 D. melanogaster)实验时,通常会有几个常见步骤:
- "果蝇分选",即通过体视显微镜观察可见标记对果蝇进行基本分选,这通常是日常操作;
- 荧光筛选,类似于果蝇分选,但通常涉及使用荧光体视显微镜观察胚胎或幼虫,以将成功转染、表达基因的个体与未表达基因的个体分开;
- 通过体视显微镜进行解剖;
- 文档记录或成像:通常使用共聚焦显微镜或复合显微镜进行,但也可以使用高性能体视显微镜。
为了清晰起见,在本文中,常规果蝇实验中提到的步骤顺序将被称为"工作流程"(参见图1)。在许多情况下,工作流程并不是线性的"流动"工作步骤。
优化果蝇工作流程效率需考虑的关键因素
在尝试开发更高效的工作流程时,有几个重要方面需要考虑:
- 确定特定研究的关键任务:例如使用可见标记或荧光蛋白标记对果蝇进行进行分类以便选择育种;
- 每个步骤所需的时间以及总步骤数:通常工作流程是日常重复、繁琐、耗时的工作,必须可靠准确地执行,以保持果蝇的所需谱系;
- 普通体视显微镜:良好的照明、分辨率和人体工学设计可以提高效率;
- 样本特性:一般来说,果蝇和其他昆虫主要由多糖壳聚糖和各种蛋白质分子组成,这些成分可能会导致自发荧光(样本的非期望背景荧光信号)[9],并降低使用荧光显微镜观察时的信噪比(S/N比);
- 荧光体视显微镜:通过快速切换滤光片、快速切换荧光和明场观察以及快速变焦,可以加快工作流程。
- 解剖:灵活的照明和显微镜支架选项确保了符合人体工程学的工作流程;
- 文档记录/成像:记录突变表型、拍摄行为变化、测量解剖特征(如翅膀或腿的大小)以及细胞迁移的时间跨度成像(通常使用共焦显微镜进行)。利用体视显微镜进行文档记录通常需要不同的数字彩色相机设置。
果蝇分选和荧光筛选的体视显微镜系统
果蝇分选
果蝇分选是根据解剖特征和表型进行日常分选 [10]。果蝇通常使用CO2麻醉,并放置在带有CO2通气垫的平台上进行分选。通常使用体视显微镜进行分选。
徕卡显微系统(Leica Microsystems)提供了几种适用于果蝇(通常为D. melanogaster)分选的体视显微镜,特别是M50、M60和M80 CMO体视显微镜 [11]。
这些显微镜提供的一些优势包括:
- 具有极高光透过率的光学器件,可以一目了然地看到许多细节,无需使用可能产生阴影或亮斑的过亮照明;
- 具有23毫米视场数(FN)的目镜,可以提供更大的视场/物体视场,让用户可以在垫子的大范围内快速概览果蝇,实现快速高效的果蝇分选【注意:M80的视场(FOV)比M50和M60小-参见图2】;
- M80具有更高的分辨率(最大数值孔径[NA]为0.206),比M60和M50(最大NA为0.15)更高的分辨率有助于识别细微的表型,如鬃毛形态;
- 对于M50和M60的较宽视场,根据应用需求,通常建议使用平面消色差物镜,而对于M80,消色差物镜就足够了 [12];
- M50、M60和M80可以配备LED2000或LED2500一体化显微镜支架和照明系统,使工作台面保持无电缆和外部光源的状态(注意:通常果蝇被放置在数百个塑料瓶中,这些瓶子占据了工作空间,偶尔设备的电缆可能会被用户碰到,并意外将一些瓶子撞落到地面);
- 体视显微镜的人体工程学配件,如ErgoWedges,可以缓解重复工作的压力(注意:当实验室中的显微镜用户在整天进行果蝇分选时感到更舒适,他们工作效率就会更高,人体工程学配件可以经济地改装到旧款徕卡显微镜上);
- 紧凑型LED光源连接在支架上,可以方便地移动体视显微镜进行清洁,并为用户提供更多的空闲台面空间。
下面的照片展示了一个典型的果蝇实验室,其中使用了M60和M80体视显微镜进行果蝇分选(照片由奥地利维也纳大学神经生物学系的T. Hummel提供)。
实用信息(提示和建议)
显微镜底座尺寸
显微镜的底座尺寸是每个实验室都要考虑的重要因素。用于CO2麻醉的果蝇垫子有不同的尺寸,但在果蝇分选过程中,它们往往会因为底座太小而从显微镜底座上滑落。
解决这个潜在问题的方法有:
- 使用中等尺寸的底座;
- 或者可以使用小型摇臂支架,直接在实验台上工作(参见图5)。LED3000聚光灯照明(SLI)通过可弯曲灯腕直接安装在摇臂支架上,所有照明控制都可以直接在可弯曲灯腕上操作,因此它们不会占据实验台的空间。
Greenough显微镜与CMO显微镜在果蝇分选方面的优势和劣势
Greenough显微镜的优势:
- 通常具有比CMO体视显微镜更长的工作距离;
- 是一种经济实惠的解决方案。
Greenough显微镜的劣势:
- 模块化程度有限;
- 每只眼睛的光学轴汇聚到放置标本的中心点。对于位于中心以外位置的标本,每只眼睛有两个不同的焦平面,无法同时清晰对焦(参见图6)。
CMO(共同主物镜)显微镜的优势:
所有标本在两只眼睛的同一焦平面上,与Greenough体视显微镜相比 [13,14] ,可以在特定放大倍数下获得更大的可用视场,并且能够实现以下效果:
- 更大范围的概览,减少了重新对焦和移动果蝇垫子的需求;
- 更快速地识别果蝇;
- 更顺畅的工作流程,使果蝇分选变得不那么乏味。
图6比较了Greenough和CMO体视显微镜的光学系统。
每种显微镜可以为用户提供以下一些优势:
荧光体视显微镜为果蝇筛选者提供以下优势:
- 独特的三束设计使其具有最佳的荧光显微镜信噪比(S/N比);
- M205 FA具有最佳分辨率(最大NA为0.349),其次是M165 FC(最大NA为0.3),然后是MZ10 F(最大NA为0.25);
- M165 FC和M205 FA使用APO物镜,而MZ10 F通常半复消色差物镜;
- M165 FC和M205 FA具有编码光学系统,可可靠测量果蝇解剖学参数,例如腿、翅膀、眼睛等的尺寸和表面积;
- M205 FA具有融合光学(FusionOptics)技术 [17] ,可以通过目镜实现最高分辨率和景深的三维视觉感知,同时即使在高放大倍数下也非常实用,这在荧光筛选中非常方便;
- M205 FA是一款完全自动化的荧光体视显微镜,因此还可用于复杂的成像,如z堆叠和多通道采集;
- 人体工程学配件(如ErgoTubes)可以调节目镜的高度和角度,减轻重复工作的负担,提高个人用户的舒适度和生产力。
解剖
对果蝇及其幼虫进行解剖可以进行更详细的器官和组织研究 [18]。通常,使用高性能体视显微镜进行解剖。
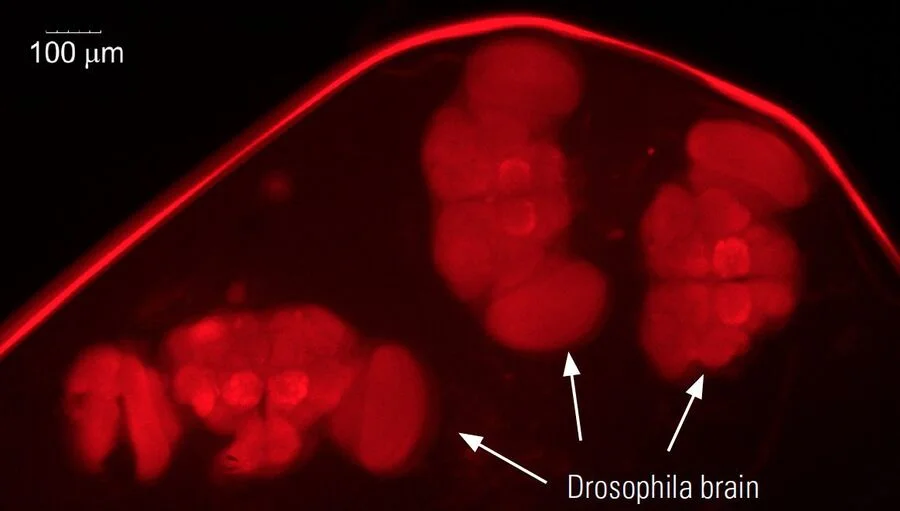
对于果蝇和幼虫的解剖,M80体视显微镜通常已经足够,但M125具有更高的放大倍数和分辨率,以及良好的视场,更适合制备果蝇器官,例如脑部(参见图8中的示例)。通常,这些器官随后会使用分辨率更高的共聚焦显微镜、复合显微镜或体视显微镜进行成像。
文档记录/成像
通常使用编码体视显微镜(如M205 FA、M165 FC、M205 A、M205 C、M165 FC或M165 C)对果蝇的眼睛、腿、身体和翅膀的突变进行表型特征描述。为了观察果蝇的行为并拍摄视频,数字显微镜非常有用,可以以较高的帧率和相对较小的设备捕捉大范围的概览。此外,Leica Application Suite X(LAS X)软件提供了扩展景深(EDOF)或图像z堆叠等功能,用于快速、常规的三维果蝇表型特征描述。使用编码Leica体视显微镜结合LAS X软件,所有图像将被正确校准,从而确保对翅膀大小、腿长、眼表面和其他相关表型变化的准确测量。
对于许多研究来说,果蝇表型的特征描述必须在亚细胞水平上进行 [19]。通常使用共聚焦或复合显微镜对解剖的果蝇部分进行文档记录,以获取亚细胞级别的细节。
M205 FA是完全编码和自动化的,可以更轻松地完成复杂的成像任务。编码和自动化提供了细胞和亚细胞水平上可靠的测量。它采用FusionOptics技术 [17],并提供人体工程学配件。
结论
果蝇(Drosophila melanogaster)作为发育生物学研究的模式生物,已超过一个世纪 [1,2]。它的基因组已经被完全测序,与人类相关的疾病基因显示出显著的同源性 [7]。
果蝇(通常是D. melanogaster)的常规工作流程涉及多个使用体视显微镜的步骤:
- 果蝇培养,对果蝇进行每日基本分类;
- 荧光筛选,观察胚胎或幼虫;
- 解剖以便后续的文档记录或成像。
通常使用体视显微镜对果蝇的解剖结构或整个器官进行文档记录,而使用共聚焦或复合显微镜对其解剖出的部分进行成像,以获取亚细胞级别的细节。
该报告涉及了科学家和技术人员研究果蝇(如D. melanogaster)的实例,并展示了使用各种不同显微镜和配件的可能配置。由于每个实验室的需求可能差异很大,因此提供了大量不同的配置和仪器,以解决工作流程中的特定任务,甚至可以通过一个仪器完成更多的工作步骤。该简短报告根据不同果蝇实验室的丰富经验提供了推荐的工作流程,可作为在建立或扩展果蝇实验室时实用的参考或指南。
致谢
感谢奥地利维也纳大学神经生物学系的Laura Geid和Thomas Hummel教授提供了他们的Drosophila实验室的照片,以及新加坡A*STAR的IMB的Bruno Reversade教授。
参考文献
- Manning G: A quick and simple introduction to Drosophila melanogaster. Drosophila Virtual Library.
- Morgan TH: Biographical – The Nobel Prize in Physiology or Medicine 1933. The Nobel Foundation, Stockholm, Sweden.
- Chromosomes. National Human Genome Research Institute (NHGRI), National Institute of Health (NIH), Bethesda, Maryland, USA.
- Mutation – Talking Glossary of Genetic Terms. National Human Genome Research Institute (NHGRI), National Institute of Health (NIH), Bethesda, Maryland, USA.
- Deletion – Talking Glossary of Genetic Terms. National Human Genome Research Institute (NHGRI), National Institute of Health (NIH), Bethesda, Maryland, USA.
- Genome – Talking Glossary of Genetic Terms. National Human Genome Research Institute (NHGRI), National Institute of Health (NIH), Bethesda, Maryland, USA.
- Reiter LT, Potocki L, Chien S, Gribskov M, and Bier E: A Systematic Analysis of Human Disease-Associated Gene Sequences In Drosophila melanogaster. Genome Res. 11 (6): 1114–25 (2001); doi: 10.1101/gr.169101.
- Herrero J: How to get all the orthologous genes between two species. Ensembl Project, Cambridge, UK.
- Hoff F: How to Prepare Your Specimen for Immunofluorescence Microscopy. Science Lab.
- Phenotype – Talking Glossary of Genetic Terms. National Human Genome Research Institute (NHGRI), National Institute of Health (NIH), Bethesda, Maryland, USA.
- Goeggel D: The History of Stereo Microscopy – Part III: The 19th Century – Breakthrough of Modern Microscope Manufacturing. Science Lab.
- Objective Classes. Leica Microsystems.
- Rottermann R, and Bauer P: How Sharp Images Are Formed: Depth of Field in Microscopy. Science Lab.
- Goeggel D: Factors to Consider When Selecting a Stereo Microscope. Science Lab.
- Genotype – Talking Glossary of Genetic Terms. National Human Genome Research Institute (NHGRI), National Institute of Health (NIH), Bethesda, Maryland, USA.
- Greb C: Fluorescent Proteins – Introduction and Photo Spectral Characteristics. Science Lab.
- Goeggel D, Schué A, Kiper D, Müller C, What is the FusionOptics Technology: Leica stereo microscopes with FusionOptics combine high resolution and depth of field for ideal 3D perception of samples, Science Lab (2023) Leica Microsystems.
- Maimon I, and Gilboa L: Dissection and Staining of Drosophila Larval Ovaries. Jove, doi: 10.3791/2537.
- De Bock J: Mosaic Images: Bringing Together What Belongs Together. Science Lab.